Promieniowanie kierunkowe. Środki wpływu
Jednostka masy atomowej. Liczba Avogadra
Materia składa się z cząsteczek. Przez cząsteczkę będziemy rozumieć najmniejszą cząsteczkę danej substancji, która zachowuje właściwości chemiczne danej substancji.
Czytelnik: W jakich jednostkach mierzy się masę cząsteczek?
Autor: Masę cząsteczki można mierzyć w dowolnych jednostkach masy, na przykład w tonach, ale ponieważ masy cząsteczek są bardzo małe: ~10–23 g, wówczas dla wygody wprowadził specjalną jednostkę - jednostka masy atomowej(południe).
Jednostka masy atomowejnazywa się wartością równą masie atomu węgla 6 C 12.
Oznaczenie 6 C 12 oznacza: atom węgla o masie 12 amu. a ładunek jądrowy wynosi 6 ładunków elementarnych. Podobnie 92U 235 to atom uranu o masie 235 amu. a ładunek jądra wynosi 92 ładunki elementarne, 8 O 16 to atom tlenu o masie 16 amu, a ładunek jądra wynosi 8 ładunków elementarnych itp.
Czytelnik: Dlaczego wybrano ją jako atomową jednostkę masy? (nie Lub ) część masy atomu, a konkretnie węgla, a nie tlenu czy plutonu?
Ustalono eksperymentalnie, że 1 g » 6,02×10 23 amu.
Nazywa się liczbą pokazującą, ile razy masa 1 g jest większa od 1 amu Liczba Avogadra: N A = 6,02×10 23.
 Stąd
Stąd
N A × (1 amu) = 1 g (5.1)
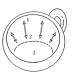
Pomijając masę elektronów i różnicę mas protonu i neutronu, możemy powiedzieć, że liczba Avogadra w przybliżeniu pokazuje, ile protonów (lub, co jest prawie tym samym, atomami wodoru) należy wziąć, aby utworzyć masę 1 g (ryc. 5.1).
Kret
Nazywa się masę cząsteczki wyrażoną w atomowych jednostkach masy względna masa cząsteczkowa .
Wyznaczony pan r(R– od krewny – krewny), na przykład:
12:00 = 235:00
Nazywa się część substancji, która zawiera tę samą liczbę gramów danej substancji, ile jest jednostek masy atomowej zawartych w cząsteczce danej substancji modlić się(1 mol).
Na przykład: 1) względna masa cząsteczkowa wodoru H2: zatem 1 mol wodoru ma masę 2 g;
2) względna masa cząsteczkowa dwutlenek węgla CO2:
![]() 12 am + 2×16 rano = 44 amu
12 am + 2×16 rano = 44 amu
zatem 1 mol CO2 ma masę 44 g.
Oświadczenie. Jeden mol dowolnej substancji zawiera tę samą liczbę cząsteczek: N A = 6,02×10 23 szt.
Dowód. Niech względna masa cząsteczkowa substancji pan r(rano) = pan r× (1 amu). Wtedy zgodnie z definicją 1 mol danej substancji ma masę pan r(g) = pan r×(1 g). Pozwalać N jest zatem liczbą cząsteczek w jednym molu
N×(masa jednej cząsteczki) = (masa jednego mola),
Mol jest podstawową jednostką miary w układzie SI.
Komentarz. Mol można zdefiniować inaczej: 1 mol to N A = = 6,02×10 23 cząsteczki tej substancji. Wtedy łatwo zrozumieć, że masa 1 mola jest równa pan r(G). Rzeczywiście, jedna cząsteczka ma masę pan r(południe), tj.
(masa jednej cząsteczki) = pan r× (1 amu),
(masa jednego mola) = N A ×(masa jednej cząsteczki) =
= N× pan r× (1 jednostka amu) = ![]() .
.
Nazywa się masą 1 mola masa molowa tej substancji.
Czytelnik: Jeśli weźmiesz masę T jakiejś substancji, której masa molowa wynosi m, to ile będzie to moli?
Pamiętajmy:
Czytelnik: W jakich jednostkach SI należy mierzyć m?
![]() , [m] = kg/mol.
, [m] = kg/mol.
Na przykład masa molowa wodoru
Mol to ilość substancji zawierająca tyle pierwiastków strukturalnych, ile jest atomów zawartych w 12 g 12 C, oraz elementy konstrukcyjne zwykle atomy, cząsteczki, jony itp. Masa 1 mola substancji wyrażona w gramach jest liczbowo równa jej molowi. masa. Zatem 1 mol sodu ma masę 22,9898 g i zawiera 6,02·10 23 atomów; 1 mol fluorku wapnia CaF 2 ma masę (40,08 + 2 18,998) = 78,076 g i zawiera 6,02 10 23 cząsteczek, podobnie jak 1 mol czterochlorku węgla CCl 4, którego masa wynosi (12,011 + 4 35,453) = 153,823 g. itp.
Prawo Avogadra.
U zarania rozwoju teorii atomowej (1811) A. Avogadro wysunął hipotezę, zgodnie z którą przy tej samej temperaturze i ciśnieniu równe objętości gazów doskonałych zawierają ten sam numer cząsteczki. Później wykazano, że hipoteza ta jest konieczną konsekwencją teorii kinetycznej i jest obecnie znana jako prawo Avogadro. Można go sformułować w następujący sposób: jeden mol dowolnego gazu w tej samej temperaturze i ciśnieniu zajmuje tę samą objętość, w standardowej temperaturze i ciśnieniu (0 ° C, 1,01×10 5 Pa) równym 22,41383 litrów. Ilość ta nazywana jest objętością molową gazu.
Sam Avogadro nie oszacował liczby cząsteczek w danej objętości, ale zrozumiał, że jest to bardzo duża wartość. Pierwszą próbę ustalenia liczby cząsteczek zajmujących daną objętość podjął w 1865 r. J. Loschmidt; Stwierdzono, że 1 cm 3 gazu doskonałego w normalnych (standardowych) warunkach zawiera 2,68675 × 10 19 cząsteczek. W imieniu tego naukowca określona wartość nazywano liczbą Loschmidta (lub stałą). Od tego czasu jest rozwijany duża liczba niezależne metody wyznaczania liczby Avogadro. Doskonała zgodność uzyskanych wartości jest przekonującym dowodem na rzeczywiste istnienie cząsteczek.
Metoda Loschmidta
ma wyłącznie znaczenie historyczne. Opiera się na założeniu, że skroplony gaz składa się ze ściśle upakowanych kulistych cząsteczek. Mierząc objętość cieczy powstałej z danej objętości gazu i znając w przybliżeniu objętość cząsteczek gazu (objętość tę można przedstawić na podstawie niektórych właściwości gazu, na przykład lepkości), Loschmidt uzyskał oszacowanie Avogadra liczba ~10 22.
Wyznaczanie na podstawie pomiaru ładunku elektronu.
Jednostka ilości energii elektrycznej, znana jako liczba Faradaya F, to ładunek przenoszony przez jeden mol elektronów, tj. F = Nie, Gdzie mi– ładunek elektronowy, N– liczba elektronów w 1 molu elektronów (tj. liczba Avogadro). Liczbę Faradaya można wyznaczyć, mierząc ilość energii elektrycznej potrzebnej do rozpuszczenia lub wytrącenia 1 mola srebra. Dokładne pomiary przeprowadzone przez Amerykańskie Krajowe Biuro Normalizacyjne dały tę wartość F= 96490,0 C i zmierzono ładunek elektronu różne metody(szczególnie w doświadczeniach R. Millikana) wynosi 1,602×10 –19 C. Stąd możesz znaleźć N. Ta metoda wyznaczania liczby Avogadro wydaje się jedną z najdokładniejszych.
Eksperymenty Perrina.
Na podstawie teorii kinetycznej otrzymano wyrażenie zawierające liczbę Avogadro opisujące spadek gęstości gazu (np. powietrza) wraz z wysokością słupa tego gazu. Gdybyśmy mogli obliczyć liczbę cząsteczek w 1 cm 3 gazu na dwóch różnych wysokościach, to korzystając z powyższego wyrażenia moglibyśmy znaleźć N. Niestety nie jest to możliwe, ponieważ cząsteczki są niewidoczne. Jednak w 1910 r. J. Perrin wykazał, że wspomniane wyrażenie obowiązuje także w przypadku zawiesin cząstek koloidalnych widocznych pod mikroskopem. Zliczenie liczby cząstek znajdujących się na różnych wysokościach w kolumnie zawiesiny dało liczbę Avogadra 6,82 × 10 23 . Z innej serii eksperymentów, w których mierzono średnie kwadratowe przemieszczenie cząstek koloidalnych w wyniku ich ruchów Browna, Perrin otrzymał wartość N= 6,86Х10 23. Następnie inni badacze powtórzyli niektóre eksperymenty Perrina i uzyskali wartości, które są w dobrej zgodzie z obecnie przyjętymi. Należy zauważyć, że eksperymenty Perrina stanowiły punkt zwrotny w podejściu naukowców do atomowej teorii materii – wcześniej część naukowców uważała ją za hipotezę. Wybitny ówczesny chemik W. Ostwald tak wyraził tę zmianę poglądów: „Zgodność ruchu Browna z wymogami hipotezy kinetycznej... zmuszała nawet najbardziej pesymistycznych naukowców do mówienia o doświadczalnym dowodzie teorii atomu .”
Obliczenia z wykorzystaniem liczby Avogadro.
Korzystając z liczby Avogadra, otrzymaliśmy dokładne wartości masy atomów i cząsteczek wielu substancji: sodu 3,819×10 –23 g (22,9898 g/6,02×10 23), czterochlorku węgla 25,54×10 –23 g itd. Można też wykazać, że 1 g sodu powinno zawierać około 3×10 22 atomów tego pierwiastka.
Zobacz także
Instrukcje
Aby znaleźć kret substancje, musisz pamiętać o bardzo prostej zasadzie: masa jednego mola dowolnego substancje jest liczbowo równa jego masie cząsteczkowej, wyrażonej jedynie w innych ilościach. Jak to ustalić? Korzystając z układu okresowego, dowiesz się o masie atomowej każdego pierwiastka wchodzącego w skład cząsteczek substancje. Następnie musisz dodać masy atomowe, biorąc pod uwagę indeks każdego pierwiastka, a otrzymasz odpowiedź.
Oblicz jego masę cząsteczkową, biorąc pod uwagę indeks każdego pierwiastka: 12*2 + 1*4 + 16*3 = 76 amu. (jednostki masy atomowej). Zatem jego masa molowa (czyli masa jednego mola) również wynosi 76, jedynie jej wymiar wynosi: gram/ kret. Odpowiedź: jedna kret saletra waży 76 gramów.
Załóżmy, że dostałeś takie zadanie. Wiadomo, że masa 179,2 pewnego gazu wynosi 352 gramy. Konieczne jest określenie, ile ktoś waży kret ten gaz. Wiadomo kiedy normalne warunki jeden kret dowolny gaz lub mieszanina gazów zajmuje objętość około 22,4 litra. I masz 179,2 litra. Wykonaj obliczenia: 179,2/22,4 = 8. Zatem ta objętość zawiera 8 moli gazu.
Dzieląc masę znaną z warunków zadania przez liczbę moli, otrzymujesz: 352/8 = 44. Zatem jeden kret Gaz ten waży 44 gramy - jest to gaz CO2.
Jeżeli istnieje pewna ilość gazu o masie M, zamknięta w objętości V, przy danej temperaturze T i ciśnieniu P. Należy wyznaczyć jego masę molową (czyli znaleźć, jaka jest jego kret). Uniwersalne równanie Mendelejewa-Clapeyrona pomoże Ci rozwiązać problem: PV = MRT/m, gdzie m jest masą molową, którą musimy wyznaczyć, a R jest uniwersalną stałą gazową równą 8,31. Przekształcając równanie, otrzymujesz: m = MRT/PV. Podstawiając znane ilości do wzoru, znajdziesz, co jest równe kret gaz.
W obliczeniach zwykle stosuje się zaokrąglone wartości mas atomowych pierwiastków. Jeżeli wymagana jest większa precyzja, zaokrąglanie jest niedopuszczalne.
Różne formuły pomoże Ci znaleźć ilość substancji, której jednostką miary jest kret. Ponadto ilość substancji można znaleźć, korzystając z równania reakcji podanego w zadaniu.
Instrukcje
Jeśli substancja chemiczna składa się z cząsteczek, jeden mol tej substancji będzie zawierał 6,02x10^23 cząsteczek. Zatem 1 mol wodoru H2 to 6,02x10^23 cząsteczek H2, 1 mol wody H2O to 6,02x10^23 cząsteczek H2O, 1 mol C6H12O6 to 6,02x10^23 cząsteczek C6H12O6.
Jeśli substancja składa się z atomów, jeden mol tej substancji będzie zawierał tę samą liczbę atomów Avogadro - 6,02x10^23. Dotyczy to np. 1 mola żelaza Fe lub siarki S.
O czym świadczy ilość substancji?
Zatem 1 mol dowolnego substancja chemiczna zawiera liczbę Avogadro cząstek tworzących daną substancję, tj. około 6,02x10^23 cząsteczek lub atomów. Całkowita ilość substancji (liczba moli) Litera łacińska ani Grecka litera"nagi". Można to znaleźć w relacji całkowita liczba cząsteczek lub atomów substancji do liczby cząsteczek w 1 molu – liczba Avogadro:
n=N/N(A), gdzie n to ilość substancji (mol), N to liczba cząstek substancji, N(A) to liczba Avogadro.
Stąd możemy wyrazić liczbę cząstek w danej ilości substancji:
Rzeczywista masa jednego mola substancji nazywana jest jej masą molową i jest oznaczona literą M. Wyrażana jest w „gramach na mol” (g/mol), ale jest liczbowo równa względnej masie cząsteczkowej substancji Mr (jeśli substancja składa się z cząsteczek) lub względną masę atomową substancji Ar, jeśli substancja składa się z atomów.
Względne masy pierwiastków można znaleźć w układzie okresowym (zwykle są one zaokrąglane podczas obliczeń). Zatem dla wodoru jest to 1, dla litu – 7, dla węgla – 12, dla tlenu – 16 itd. Względne masy cząsteczkowe składają się ze względnych mas atomowych atomów tworzących cząsteczkę. Na przykład względna masa cząsteczkowa wody H2O
Mr(H2O)=2xAr(H)+Ar(O)=2x1+16=18.
Względne masy atomowe i molekularne są wielkościami bezwymiarowymi, ponieważ wyrażają masę atomu i cząsteczki w stosunku do jednostka konwencjonalna– 1/12 masy atomu węgla.
W typowych zadaniach zazwyczaj trzeba dowiedzieć się, ile cząsteczek lub atomów zawiera się w danej ilości substancji, co stanowi dana ilość substancji, ile cząsteczek znajduje się w danej masie. Ważne jest, aby zrozumieć, że substancja wskazuje liczbę moli każdego pierwiastka zawartego w jej składzie. Oznacza to, że 1 mol H2SO4 zawiera 2 mole atomów wodoru H, 1 mol atomów siarki S, 4 mole atomów tlenu O.
Kret- jedno z najważniejszych pojęć w chemii, jest w pewnym sensie łącznikiem przejścia z mikroświata atomów i cząsteczek do zwykłego makroświata gramów i kilogramów.
W chemii często musimy liczyć duże liczby atomów i cząsteczek. W celu szybkiego i wydajnego obliczenia zwykle stosuje się metodę ważenia. Ale jednocześnie musisz znać masę poszczególnych atomów i cząsteczek. Aby poznać masę cząsteczkową, należy zsumować masy wszystkich atomów wchodzących w skład związku.
Weźmy cząsteczkę wody H 2 O, która składa się z jednego atomu tlenu i dwóch atomów wodoru. Z układ okresowy Mendelejewa dowiadujemy się, że jeden atom wodoru waży 1,0079 amu. ; jeden atom tlenu - 15,999 amu. Teraz, aby obliczyć masę cząsteczkową wody, musimy dodać masy atomowe składników cząsteczki wody:
H2O = 2 1,0079 + 1 15,999 = 18,015 amu
Na przykład dla siarczanu amonu masa cząsteczkowa będzie wynosić:
Al 2 (SO 4) 3 = 2 26,982 + 3 32,066 + 12 15,999 = 315,168 amu.
Wróćmy jeszcze do życie codzienne, w którym zwykliśmy posługiwać się takimi pojęciami jak para, dziesięć, tuzin, sto. Wszystko to jest wyjątkowe różne jednostki wymiary niektórych przedmiotów: para butów, tuzin jajek, sto spinaczy. Podobną jednostką miary w chemii jest MOL.
Współczesna nauka określiła z dużą dokładnością liczbę jednostek strukturalnych (cząsteczek, atomów, jonów...) zawartych w 1 molu substancji - wynosi to 6,022 10 23 - Stała Avogadro, Lub Liczba Avogadra.
Wszystkie powyższe informacje na temat molo odnoszą się do mikrokosmosu. Teraz musimy połączyć koncepcję kreta z codziennym makrokosmosem.
Cały niuans polega na tym, że 12 gramów izotopu węgla 12 C zawiera 6,022·10 23 atomów węgla, czyli dokładnie 1 mol. Zatem w przypadku dowolnego innego pierwiastka mol wyraża się w gramach równej masie atomowej pierwiastka. W przypadku związków chemicznych mol wyraża się w liczbie gramów równej masie cząsteczkowej związku.
Nieco wcześniej dowiedzieliśmy się, że masa cząsteczkowa wody wynosi 18,015 amu. Biorąc pod uwagę zdobytą wiedzę o molu, można powiedzieć, że masa 1 mola wody = 18,015 g (ponieważ mol związku to liczba gramów równa jego masie cząsteczkowej). Innymi słowy, możemy powiedzieć, że 18,015 g wody zawiera 6,022 10 23 cząsteczek H 2 O, czyli 1 mol wody = 1 mol tlenu + 2 mole wodoru.
Z powyższego przykładu jasne jest połączenie mikrokosmosu z makrokosmosem poprzez kret:
Liczba Avogadra ↔ MOL ↔ liczba gramów równa masie atomowej (wzór)- n - ilość substancji, mol;
- N - liczba cząstek;
- N A - liczba Avogadro, mol -1
Oto kilka praktyczne przykłady kret używa:
Zadanie nr 1: Ile cząsteczek wody znajduje się w 16,5 molach H2O?
Rozwiązanie: 16,5 6,022 10 23 = 9,93 10 24 cząsteczki.
Zadanie nr 2: Ile moli znajduje się w 100 gramach H2O?
Rozwiązanie:(100 g/1)·(1 mol/18,015 g) = 5,56 mol.
Zadanie nr 3: Ile cząsteczek zawiera 5 g dwutlenku węgla?
Rozwiązanie:
- Określ masę cząsteczkową CO 2: CO 2 = 1 12,011 + 2 15,999 = 44,01 g/mol
- Znajdź liczbę cząsteczek: (5g/1)·(1mol/44,01g)·(6,022·10 23 /1mol) = 6,84·10 22 cząsteczki CO 2
Instrukcje
Znając wielkość ν, znajdź liczbę cząsteczki w tym. W tym celu należy pomnożyć ilość substancji wyrażoną w molach przez stałą Avogadro (NA=6,022∙10^23 1/mol), która jest równa liczbie cząsteczki w 1 molu substancji N=ν/NA. Na przykład, jeśli jest 1,2 mola soli kuchennej, to zawiera ona N = 1,2∙6,022∙10^23 ≈7,2∙10^23 cząsteczki.
Jeśli substancja jest znana, skorzystaj z układu okresowego pierwiastków, aby znaleźć jej masę molową. Aby to zrobić, skorzystaj z tabeli, aby znaleźć względne masy atomowe atomów tworzących cząsteczki och, i złóż je. W rezultacie otrzymasz krewnego cząsteczki pozorna masa substancji, która jest liczbowo równa jej masie molowej na mol. Następnie na skali zmierz masę badanej substancji w . Aby znaleźć ilość cząsteczki V substancja, pomnóż masę substancji m przez stałą Avogadro (NA=6,022∙10^23 1/mol) i podziel wynik przez masę molową M (N=m∙NA/M).
Przykład Określ ilość cząsteczki, który zawarty jest w 147 g. Znajdź masę molową. Jej cząsteczki a składa się z 2 atomów wodoru, jednego atomu siarki i 4 atomów tlenu. Ich masy atomowe wynoszą 1, 32 i 16. Względne cząsteczkiŚrednia masa wynosi 2∙1+32+4∙16=98. Jest równa masie molowej, więc M = 98 g/mol. Następnie ilość cząsteczki zawarty w 147 g kwasu siarkowego będzie równy N=147∙6,022∙10^23/98≈9∙10^23 cząsteczki.
Aby znaleźć ilość cząsteczki gaz w normalnych warunkach w temperaturze 0°С 760 mm Hg. kolumnie, znajdź jej objętość. Aby to zrobić, zmierz lub oblicz V, w którym się znajduje, w litrach. Aby znaleźć ilość cząsteczki gazu, podziel tę objętość przez 22,4 litra (objętość jednego mola gazu w normalnych warunkach) i pomnóż przez liczbę Avogadro (NA=6,022∙10^23 1/mol) N= V∙NA/22,4.
Źródła:
- jak określić liczbę cząsteczek
A. Avogadro w 1811 r., już na samym początku rozwoju teorii atomowej, przyjął założenie, że równa liczba gazów doskonałych pod tym samym ciśnieniem i temperaturą zawiera tę samą liczbę cząsteczek. Później założenie to zostało potwierdzone i stało się konieczną konsekwencją teorii kinetycznej. Teraz teoria ta nazywa się Avogadro.
Instrukcje
Wideo na ten temat
Cząsteczka to cząstka obojętna elektrycznie, która ma wszystko właściwości chemiczne nieodłącznie związane z tą konkretną substancją. W tym gazy: tlen, azot, chlor itp. Jak określić liczbę cząsteczek gazu?

Instrukcje
Jeśli chcesz obliczyć, ile tlenu zawiera 320 tego gazu w normalnych warunkach, przede wszystkim określ, ile moli tlenu zawiera się w tej ilości. Według układu okresowego widać, że zaokrąglona masa atomowa tlenu wynosi 16 jednostek atomowych. Ponieważ cząsteczka tlenu jest dwuatomowa, masa cząsteczki wyniesie 32 jednostki atomowe. Dlatego liczba moli wynosi 320/32 = 10.
Następnie pomoże ci uniwersalna liczba Avogadro, nazwana w, która przyjęła, że równe objętości ideałów stałe warunki zawierają tę samą liczbę cząsteczek. Jest on oznaczony symbolem N(A) i jest bardzo duży – 6,022*10(23). Pomnóż tę liczbę przez obliczoną liczbę moli tlenu, a przekonasz się, że wymagana liczba cząsteczek w 320 gramach tlenu wynosi 6,022*10(24).
A co jeśli potrzebujesz tlenu, a także zajmowanej przez niego objętości i temperatury? Jak obliczyć liczbę jego cząsteczek przy takich danych? I nie ma tu nic skomplikowanego. Wystarczy zapisać uniwersalne równanie Mendelejewa-Clapeyrona dla gazów doskonałych:
Gdzie P to ciśnienie gazu w paskalach, V to jego objętość w metrów sześciennych, R jest uniwersalną stałą gazu, M jest masą gazu, a m jest jego masą molową.
Nieznacznie przekształcając to równanie, otrzymasz:
Ponieważ masz wszystkie niezbędne dane (ciśnienie, objętość, temperatura są wstępnie ustawione, R = 8,31 i masa molowa tlenu = 32 gramy/mol), możesz łatwo znaleźć masę gazu przy danej objętości, ciśnieniu i . Następnie problem rozwiązuje się dokładnie tak samo, jak w przykładzie opisanym powyżej: N(A)M/m. Dokonując obliczeń dowiesz się, ile cząsteczek tlenu zawiera się w danych warunkach.
Wideo na ten temat
Przydatne rady
Żaden prawdziwy gaz (w tym tlen) nie jest oczywiście idealny, dlatego równanie Mendelejewa-Clapeyrona można wykorzystać do obliczeń tylko w warunkach, które nie różnią się zbytnio od normalnych.
Cząsteczka ma tak małe wymiary, że liczba cząsteczek nawet w maleńkim ziarenku lub kropli jakiejkolwiek substancji będzie po prostu ogromna. Nie można go zmierzyć konwencjonalnymi metodami obliczeniowymi.

Co to jest „mol” i jak go używać do obliczania liczby cząsteczek w substancji
Aby określić, ile cząsteczek znajduje się w danej ilości substancji, stosuje się pojęcie „mola”. Mol to ilość substancji zawierająca 6,022*10^23 jej cząsteczek (lub atomów lub jonów). Ta ogromna wartość nazywa się „stałą Avogadro” i została nazwana na cześć słynnego włoskiego naukowca. Wartość jest oznaczona NA. Korzystając ze stałej Avogadra, można bardzo łatwo określić, ile cząsteczek zawiera się w dowolnej liczbie moli dowolnej substancji. Na przykład 1,5 mola zawiera 1,5*NA = 9,033*10^23 cząsteczek. W przypadkach, gdy wymagana jest bardzo duża dokładność pomiaru, konieczne jest wykorzystanie wartości liczby Avogadra duża liczba miejsca dziesiętne. Jego najbardziej kompletna wartość to: 6,022 141 29(27)*10^23.
Jak znaleźć liczbę moli substancji?
Określenie, ile moli zawiera pewna ilość substancji, jest bardzo proste. Aby to zrobić, wystarczy mieć pod ręką dokładny wzór substancji i układ okresowy. Załóżmy, że masz 116 gramów zwykłej soli kuchennej. Czy musisz określić, ile moli jest zawartych w takiej ilości (i odpowiednio, ile jest cząsteczek)?
Przede wszystkim pamiętaj o wzorze chemicznym soli kuchennej. Wygląda to tak: NaCl. Cząsteczka tej substancji składa się z dwóch atomów (dokładniej jonów): sodu i chloru. Jaka jest jego masa cząsteczkowa? Składa się z mas atomowych pierwiastków. Korzystając z układu okresowego wiesz, że masa atomowa sodu wynosi w przybliżeniu 23, a masa atomowa chloru 35. Zatem masa cząsteczkowa tej substancji wynosi 23 + 35 = 58. Masę mierzy się w atomowych jednostkach masy, gdzie za standard przyjmuje się najlżejszy atom - wodór.
Znając masę cząsteczkową substancji, możesz natychmiast określić jej masę molową (to znaczy masę jednego mola). Faktem jest, że liczbowo masa cząsteczkowa i molowa są całkowicie takie same, mają tylko różne jednostki miary. Jeśli masę cząsteczkową mierzy się w jednostkach atomowych, wówczas masę molową mierzy się w gramach. Zatem 1 mol soli kuchennej waży około 58 gramów. I zgodnie z warunkami problemu masz 116 gramów soli kuchennej, czyli 116/58 = 2 mole. Mnożąc liczbę 2 przez stałą Avogadra, otrzymujemy, że w 116 gramach sodu znajduje się około 12,044*10^23 cząsteczek, czyli około 1,2044*10^24.
- Jak sprawdzić wyniki ujednoliconego egzaminu państwowego na podstawie danych paszportowych
- Wersja demonstracyjna części ustnej OGE w języku rosyjskim
- Wolfgang Amadeusz Mozart – biografia, zdjęcia, twórczość, życie osobiste kompozytora
- Liczby angielskie z transkrypcją i wymową rosyjską, edukacja, przykłady
- Udomowienie, czyli jak człowiek zmienił zwierzęta
- Prezentacja na temat „Kanada” Slajdy o Kanadzie w języku angielskim
- Czym jest Psałterz i dlaczego warto go czytać?
- Znaczenie słowa „dobry” w rosyjskiej prawosławnej literaturze teologicznej
- Wykresy i terminologia Rodzaje wierzchołków grafów
- Rachunkowość podatkowa środków trwałych Podatek i rachunkowość OS
- Kontrola podatkowa w Federacji Rosyjskiej Pojęcie, formy i metody kontroli podatkowej
- Dlaczego marzysz o czerwonej poduszce?
- Pomóż w interpretacji wymarzonej książki
- Wróżenie na fusach kawy
- Owsianka mleczna z wermiszelem
- Jak zrobić domowego szampana z liści winogron
- Pożyczka dla przedsiębiorców indywidualnych z zerową sprawozdawczością
- Rolada z mięsa mielonego z jajkami na twardo
- Konfitura morelowa „Pyatiminutka” bez nasion: przygotowana szybko i smacznie
- Pomiar szybkości umysłowej i czasu reakcji