مکانیسم جایگزینی الکتروفیلیک در هیدروکربن های آروماتیک جایگزینی الکتروفیل در سیستم های آروماتیک
l- ابر الکترونی حلقه معطر در معرض حمله معرف های الکتروفیل است.
آرنها وارد واکنشهای یونی میشوند که از طریق مکانیسم جایگزینی الکتروفیلیک انجام میشود که با نماد نشان داده میشود. اس ای(از انگلیسی جایگزینی الکتروفیل).
به طور کلی، جایگزینی یک پروتون در حلقه بنزن توسط یک ذره الکتروفیل E + را می توان به صورت زیر نشان داد:
واکنش طی چندین مرحله انجام می شود. اول از همه، لازم است یک ذره الکتروفیل از یک مولکول معرف خنثی E-Y ایجاد شود. این امر با استفاده از یک کاتالیزور به دست می آید که می تواند پیوند E-Y را به شدت قطبی کند یا به طور هترولیتیکی آن را به طور کامل بشکند.
یک ذره الکتروفیل یک ناپایدار را تشکیل می دهد n-کمپلکس،که در آن به طور همزمان با تمام الکترون های پی سیستم آروماتیک مرتبط است.
در مرحله تعیین کننده (آهسته)، ذره الکتروفیل یک پیوند کووالانسی با یکی از اتم های کربن به دلیل دو الکترون سیستم pi حلقه ایجاد می کند. در این حالت اتم کربن از آن خارج می شود sp 2 -در حالت هیبریدی sp 3 و سیستم آروماتیک مختل می شود. چهار الکترون پی باقی مانده در بین پنج اتم کربن حلقه توزیع شده و مولکول بنزن به مجموعه سیگما(کربوکاسیون).
در مرحله نهایی (سریع)، o-complex تثبیت می شود. تثبیت نه از طریق افزودن یک ذره هسته دوست، همانطور که در واکنش افزودن در آلکن ها انجام شد، بلکه از طریق انتزاع یک پروتون از اتم کربن مرتبط با الکتروفیل، سودمندتر است. در این حالت، با مشارکت دو الکترون از پیوند C-H شکسته، یک سیستم پی آروماتیک بسته دوباره ایجاد می شود.
در زیر، با استفاده از بنزن به عنوان مثال، مهمترین واکنش های جایگزینی الکتروفیل نشان داده شده است.
هالوژناسیونبنزن در شرایط عادی با کلر یا برم واکنش نمی دهد. واکنش تنها در حضور کاتالیزورها، که اغلب هالیدهای آلومینیوم بی آب یا آهن (III) هستند، رخ می دهد. در نتیجه، آرن های جایگزین هالوژن تشکیل می شوند.

نقش کاتالیزور قطبی کردن مولکول هالوژن خنثی و تبدیل آن به یک ذره الکتروفیل است. هنگامی که یک مولکول هالوژن با یک کاتالیزور برهمکنش می کند، مجموعه ای تشکیل می شود که در آن پیوند بین اتم های هالوژن به شدت قطبی شده است. در نتیجه، تجزیه کمپلکس ممکن است با تشکیل یک کاتیون هالوژن، به عنوان مثال C1 +، که یک الکتروفیل قوی است، رخ دهد. 
نیتراسیونبنزن عملا با اسید نیتریک غلیظ حتی زمانی که گرم می شود واکنش نشان نمی دهد. با این حال، هنگامی که در معرض مخلوطی از اسیدهای نیتریک و سولفوریک غلیظ قرار می گیرند، به اصطلاح مخلوط نیتراتاتم هیدروژن به راحتی با گروه نیترو NO2 جایگزین می شود - یک واکنش نیتراسیون.

ذره الکتروفیل مهاجم در این واکنش کاتیون نیتروئیل NO2 + است که از برهمکنش اسیدهای نیتریک و سولفوریک تشکیل شده است.
سولفوناسیون.بنزن هنگام گرم شدن با اسید سولفوریک غلیظ یا حتی بهتر از آن با اولئوم (محلول تری اکسید گوگرد S0 3 در اسید سولفوریک) واکنش نشان می دهد. در نتیجه، اتم هیدروژن با یک گروه سولفونیک S0 3 H با تشکیل اسید سولفونیک جایگزین می شود.

سولفوناسیون آرن ها یک واکنش برگشت پذیر است. هنگامی که با بخار آب گرم می شود، یک واکنش معکوس رخ می دهد - گوگرد زدایی
آلکیلاسیونورود گروه های آلکیل به حلقه آروماتیک توسط عمل هالوآلکان ها به عنوان شناخته شده است. واکنش Friedel-Crafts(1877). در نتیجه، همولوگ های آرن ها تشکیل می شوند.
آلکیلاسیون در حضور کاتالیزورهای مشابه در واکنش هالوژناسیون، به عنوان مثال هالیدهای آلومینیوم، رخ می دهد. نقش کاتالیزورهایی که مولکول هالوآلکان را برای تشکیل ذره الکتروفیل قطبی می کنند نیز مشابه است. 
معرفی
واکنشهای جایگزینی الکتروفیل واکنشهای جایگزینی هستند که در آن حمله توسط یک الکتروفیل (ذرهای که کمبود الکترون دارد) انجام میشود و وقتی پیوند جدیدی تشکیل میشود، ذره بدون جفت الکترونی خود شکافته میشود (واکنشهای نوع SE).
نمای کلی واکنش
عوامل الکتروفیلیک
عوامل الکتروفیل را می توان به 3 گروه تقسیم کرد:
.الکتروفیل های قوی: .NO2+ (یون نیترونیوم)؛ مجتمع های Cl2 یا Br2 با اسیدهای لوئیس مختلف (FeCl3، AlBr3، AlCl3، SbCl5، و غیره)؛ H2OCl+، H2OBr+، RSO2+، HSO3+، H2S2O7. .الکتروفیل های با قدرت متوسط: مجتمع های آلکیل هالیدها یا آسیل هالیدها با اسیدهای لوئیس (RCl. AlCl3،. AlCl3، و غیره). مجتمع های الکلی با اسیدهای قوی لوئیس و برونستد (ROH. BF3، ROH. H3PO4، ROH. HF). .الکتروفیل های ضعیف: دیازونیوم، کاتیون های ایمینیوم CH2=N+H2، نیتروزونیوم NO+ (کاتیون نیتروزوئیل). مونوکسید کربن (IV) CO2. الکتروفیلهای قوی با ترکیبات سری بنزن که هم حاوی الکترون دهنده و هم تقریباً هر جایگزین الکترونکشنده هستند، برهم کنش میکنند. الکتروفیلهای گروه دوم با بنزن و مشتقات آن حاوی جانشینهای اهداکننده (فعالکننده) الکترون یا اتمهای هالوژن واکنش میدهند، اما معمولاً با مشتقات بنزن حاوی جانشینهای الکترونکشنده قوی غیرفعالکننده (NO2، SO3H، COR، CN و غیره) واکنش نمیدهند. . در نهایت، الکتروفیلهای ضعیف فقط با مشتقات بنزن حاوی جایگزینهای بسیار قوی از نوع اهداکننده الکترون (+M) (OH، OR، NH2، NR2، O-، و غیره) برهمکنش میکنند. انواع مکانیسم ها می توان دو مکانیسم ممکن را برای جایگزینی یک پروتون در یک مولکول معطر با یک معرف الکتروفیل تصور کرد. .انتزاع یک پروتون می تواند همزمان با تشکیل یک پیوند جدید با معرف الکتروفیل E اتفاق بیفتد و واکنش در این حالت در یک مرحله انجام می شود: برای یک فرآیند همزمان، تغییر بار روی بستر در طول واکنش باید نسبتاً کم باشد. علاوه بر این، از آنجایی که پیوند C-H در مرحله تعیین کننده سرعت واکنش شکسته می شود، می توان انتظار داشت که در یک مکانیسم سنکرون واکنش باید با اثر ایزوتوپ هیدروژن جنبشی قابل توجهی همراه باشد. در ابتدا، عامل الکتروفیلیک به آن اضافه می شود π- سیستم هسته معطر، یک واسطه کم پایدار تشکیل می شود. سپس، یک پروتون از کاتیون به دست آمده تحت عمل یک پایه که می تواند یک مولکول حلال باشد، حذف می شود: واکنش هایی که با این مکانیسم انجام می شوند باید با حساسیت نرخ بالا به اثرات الکترونیکی جانشین ها مشخص شوند، زیرا واسطه یک کاتیون است. علاوه بر این، اگر مرحله تعیین سرعت اولین مرحله باشد که در آن پیوند C-H شکسته نشده باشد، واکنش نباید با اثر ایزوتوپ جنبشی قابل توجهی همراه باشد. هنگامی که ترکیبات معطر با معرف های الکتروفیل تعامل می کنند، دو نوع کمپلکس می توانند تشکیل شوند که می توانند واسطه ای در واکنش های جایگزینی الکتروفیل باشند. اگر عامل الکتروفیل به طور قابل توجهی الکترون را از بین نبرد π- سیستم حلقه معطر تشکیل می شود π- مجتمع ها وجود داشتن π- کمپلکس ها توسط داده های طیف سنجی UV، تغییرات در حلالیت، فشار بخار و دمای انجماد تایید می شوند. تحصیلات π- کمپلکس ها به عنوان مثال برای برهمکنش هیدروکربن های معطر با کلرید هیدروژن یا یون Ag+ ثابت شده اند: از آنجایی که ساختار الکترونیکی حلقه معطر کمی تغییر می کند (می توان یک قیاس بین این مجتمع ها و مجتمع های انتقال بار رسم کرد)، پس از تشکیل π مجتمعها تغییرات قابلتوجهی در طیفها وجود ندارد، هیچ افزایشی در هدایت الکتریکی مشاهده نمیشود. تأثیر اثرات الکترونیکی جانشین ها بر روی حلقه آروماتیک بر پایداری π- مجتمع ها نسبتا کوچک هستند، زیرا انتقال شارژ به π - مجتمع ها کوچک هستند. هنگامی که هیدروکربن های معطر در هیدروژن فلوراید مایع حل می شوند، مولکول هیدروکربن معطر برای تشکیل یون آرنونیوم پروتونه می شود و کمپلکس هایی از نوع متفاوت به دست می آید - δ- مجتمع ها پایداری δ -کمپلکس ها (یون های آرنیوم)، بر خلاف پایداری کمپلکسها، بسیار به تعداد و ماهیت جانشینهای موجود در حلقه بنزن بستگی دارد. . تحصیلات δ -کمپلکس ها به دلیل برهمکنش با فلوراید بور (III) یا سایر اسیدهای لوئیس به تثبیت یون ضد کمک می کنند: در حضور اسیدهای لوئیس δ -کمپلکس ها نیز با کلرید هیدروژن تشکیل می شوند. حد واسط δ- این مجموعه دارای چندین ساختار رزونانس است و بسیار شبیه به "کاتیون سوپرآلیل" است که بار مثبت موجود در آن بر روی سه اوربیتال از پنج اوربیتال p موجود توزیع شده است. این سیستم شامل دو اتم کربن ارتو یکسان نسبت به اتم کربن هیبرید شده با sp3 و یک اتم پارا کربن نسبت به همان اتم است. دو موقعیت متا معادل حلقه هیچ بار رسمی ندارند، اما به دلیل وجود اتمهای کربن با بار مثبت مجاور، به وضوح کمی الکترومثبت هستند: در طول تحصیل δ - مجتمع ها افزایش شدیدی در هدایت الکتریکی محلول وجود دارد. راه اصلی تبدیل یون های آرنونیوم در محلول، انتزاع پروتون با بازسازی سیستم آروماتیک است. از آنجایی که تشکیل یون آرنونن یک بار مثبت کامل را در حلقه آروماتیک محلی می کند، تأثیر اثرات الکترونیکی جانشین ها بر پایداری نسبی δ - باید به طور قابل توجهی پیچیده تر از مورد وجود داشته باشد π- مجتمع ها بنابراین، می توان انتظار داشت که واکنش جایگزینی الکتروفیل ابتدا از طریق مرحله تشکیل رخ دهد π- پیچیده و سپس δ- مجتمع ایزومری δ- مجتمع ها در یک حالت انتقالی قبل از تشکیل δ - پیچیده، بین مولکول بنزن تک جایگزین C6H5X و الکتروفیل با بار مثبت E+، بار بین الکتروفیل مهاجم و حلقه بنزن تقسیم می شود. اگر حالت گذار "اوایل" باشد (شبیه به واکنش دهنده ها)، بار روی حلقه بنزن کوچک است و عمدتاً روی الکتروفیل موضعی است، و اگر حالت گذار "دیر" باشد (شبیه به یون آرنونیوم)، پس بار عمدتاً روی اتمهای کربن حلقه بنزن متمرکز میشود. برای واکنشهای بنزنهای تک جایگزین، چهار کمپلکس میتواند وجود داشته باشد: ارتو، متا، پارا و درونی: ارتو- متا جفت- ipso- بر این اساس، چهار حالت گذار مختلف می تواند وجود داشته باشد که انرژی آنها به درجه برهمکنش جانشین X با بار مثبت حلقه بستگی دارد. در حالت گذار "تأخر"، اثر قطبی جانشین X باید بیشتر از حالت گذار "اوایل" باشد، اما از نظر کیفی تأثیر همان جانشین باید یکسان باشد. محصولات جایگزینی هیدروژن از ارتو-، متا- و پارا کمپلکس ها (با حذف یک پروتون) تشکیل می شوند، اما یک محصول جایگزین گروه X می تواند از یک کمپلکس داخلی با حذف کاتیون X+ تشکیل شود. Ipso-Substitution برای ترکیبات آلی فلزی معمول است. به عنوان یک قاعده، در آنها فلز سبک تر از پروتون جایگزین می شود: طبقه بندی جایگزین ها در حال حاضر، جایگزین ها بر اساس اثر فعال یا غیرفعال کننده و همچنین جهت جانشینی در حلقه بنزن به سه گروه تقسیم می شوند. 1.فعال سازی گروه های ارتوپراگرا. این موارد عبارتند از: NH2، NHR، NR2، NHAc، OH، OR، OAc، Alk و غیره. 2.غیرفعال کردن گروههای اورتو-پاراگرا. این هالوژن های F، Cl، Br و I هستند. این دو گروه (1 و 2) از جانشین ها را orientants نوع اول می نامند. 3.غیرفعال کردن گروه های فراگرا این گروه شامل NO2، NO، SO3H، SO2R، SOR، C(O)R، COOH، COOR، CN، NR3+، CCl3، و غیره است. این ها از نوع دوم هستند. به طور طبیعی، گروه هایی از اتم ها با طبیعت متوسط نیز وجود دارد که باعث ایجاد جهت گیری مخلوط می شود. اینها به عنوان مثال عبارتند از: CH2NO، CH2COCH3، CH2F، CHCl2، CH2NO2، CH2CH2NO2، CH2CH2NR3+، CH2PR3+، CH2SR2+، و غیره. نمونه هایی از تأثیر جهت گیری ها: واکنشهای جایگزینی آروماتیک الکتروفیلیک پایه نیتراسیون یکی از واکنش های جایگزینی که به طور گسترده مورد مطالعه قرار گرفته در سیستم های آروماتیک، نیتراسیون است. عرصه های مختلف تحت شرایط مختلف نیترات می شوند. اغلب، اسید نیتریک مخلوط با اسید سولفوریک یا اسید نیتریک در حلال های آلی: اسید استیک، نیترو متان و غیره به عنوان عامل نیترات کننده استفاده می شود. بنزن جایگزین نشده معمولاً با مخلوطی از اسیدهای نیتریک و سولفوریک غلیظ در دمای 50-45 درجه سانتی گراد نیترات می شود. این معرف مخلوط نیترات کننده نامیده می شود. ثابت شده است که در نیتراسیون الکتروفیل، صرف نظر از ماهیت عامل نیترات کننده، الکتروفیل فعال یون نیترونیم NO2+ است. در مقادیر زیاد اسید سولفوریک غلیظ، تبدیل کمی اسید نیتریک به سولفات هیدروژن نیترونیوم رخ می دهد: هنگامی که اسید سولفوریک با آب رقیق می شود، غلظت یون NO2+ کاهش می یابد و در همان زمان میزان نیتراسیون به شدت کاهش می یابد. با این حال، آرن های بسیار واکنش پذیر حتی در شرایطی که تشخیص یون NO2+ در محلول با هر روش فیزیکی غیرممکن است، نیترات می شوند. شواهدی وجود دارد که حتی در غیاب اسید سولفوریک، نیتراسیون توسط یون نیترونیم انجام می شود. در چنین شرایطی، واکنشهای آرنهای بسیار فعال نسبت به بستر معطر دارای نظم جنبشی صفر هستند (مرحله کند تشکیل NO2+ بدون مشارکت ArH است). تحت شرایط یکسان، برای آرن های کمتر واکنش پذیر، ترتیب جنبشی در ArH اول است، یعنی. مرحله محدود کننده نرخ، خود فرآیند جایگزینی است. یک اثر مشابه، به عنوان مثال، در هنگام نیتراسیون تولوئن با محلول آبی اسیدهای نیتریک و سولفوریک مشاهده شد. در غلظتهای پایین H2SO4 ترتیب تولوئن صفر و در غلظتهای بالاتر اول بود. هنگام استفاده از مخلوط نیترات کننده (HNO3 + H2SO4) به عنوان یک معرف، غلظت یون های نیترونیوم در محلول همیشه بسیار بالا است و زمانی که معرف بیش از حد باشد ثابت است، بنابراین نیتراسیون را می توان به عنوان یک فرآیند دو مرحله ای در نظر گرفت. مرحله آهسته این فرآیند دو مرحله ای شکل گیری است -پیچیده این با عدم وجود اثر ایزوتوپ جنبشی هیدروژن در طول نیتراسیون آرن ها و دوتروآرن ها ثابت می شود. با این حال، معرفی گروه های بسیار حجیم در دو طرف هیدروژن جایگزین می تواند سرعت مرحله k2 را تا حد زیادی کاهش دهد و منجر به ظهور یک اثر ایزوتوپی شود. هالوژناسیون (به عنوان مثال، برم) بنزن توسط عمل خود هالوژن تنها در حضور کاتالیزورهایی مانند ZnCl2، FeBr3، AlBr3 و غیره رخ می دهد. کاتالیزورها معمولاً اسیدهای لوئیس هستند. آنها باعث قطبی شدن مولکول هالوژن می شوند و در نتیجه خاصیت الکتروفیلیک آن را تقویت می کنند و پس از آن مولکول های قطبی شده حمله می کنند. π -الکترون های حلقه معطر در ناحیه ای که بار مثبت دارند: پس از جدا شدن پیوند برم-برم، δ- مجتمع با بنزن، که از آن کمپلکس با بار منفی -Br FeBr3 یک پروتون را انتزاع می کند و برم-بنزن می دهد. از محلول های آبی HO-Hal نیز می توان به عنوان عامل هالوژنه استفاده کرد، البته در حضور اسیدهای قوی. شواهد قابل اعتمادی وجود دارد که به عنوان مثال در کلرزنی، عامل کلرکننده یون Cl+ است که در نتیجه واکنش ایجاد می شود: مکانیسم برهمکنش بیشتر یون های Cl+ با بنزن با مکانیسم نیتراسیون با یون های NO2+ تفاوتی ندارد. شباهت این دو فرآیند با این واقعیت تأیید می شود که خود اسید HOCl و همچنین HNO3 بسیار ضعیف با بنزن برهمکنش می کنند. در هر دو مورد، اسیدهای قوی برای آزادسازی یونهای Cl+ و NO2+ توسط پروتونه کردن «مولکولهای حامل» مورد نیاز هستند: شواهد بیشتری مبنی بر اینکه عوامل جایگزین، کاتیون های هالوژن یا کمپلکس های هالوژن دار قطبی شده هستند، از مطالعات واکنش های بین اینترهالید و ترکیبات آروماتیک به دست آمده است. بنابراین، به عنوان مثال، عمل BrCl فقط به برم شدن منجر می شود، و ICl فقط به ید شدن منجر می شود، یعنی همیشه یک هالوژن کمتر الکترونگاتیو به مولکول یک ترکیب معطر وارد می شود، که در مولکول اصلی ترکیب اینترهالید دارای یک مثبت جزئی است. شارژ، به عنوان مثال: δ+ δ- → Cl سولفوناسیون. هنوز هیچ اتفاق نظری در مورد ماهیت واقعی عامل سولفوناسیون الکتروفیل وجود ندارد. داده های اندازه گیری جنبشی پاسخ روشنی به این سوال ارائه نمی دهد، زیرا اسید سولفوریک آبی و بی آب حاوی تعداد زیادی عوامل الکتروفیلیک بالقوه است که غلظت نسبی آنها به نسبت H2O/SO3 بستگی دارد. هنگامی که غلظت اسید سولفوریک زیر 80٪ باشد، تعادل های زیر عمدتا برقرار می شود: در غلظت های بالاتر اسید سولفوریک در محدوده 85-98٪، وضعیت اسید سولفوریک عمدتاً با معادلات توصیف می شود: در اسید سولفوریک 100٪ و در اولئوم، علاوه بر H2S2O7، اسیدهای پلی سولفوریک دیگری نیز وجود دارد - H2S3O10. H2S4O13 و غیره همه اینها تفسیر داده های مربوط به سینتیک سولفوناسیون را بسیار دشوار می کند. در اسید سولفوریک آبی در غلظت های زیر 80 درصد، میزان سولفوناسیون به طور خطی با فعالیت یون H3SO4+ همبستگی دارد. در غلظت های اسید سولفوریک بالای 85 درصد، یک همبستگی خطی با فعالیت H2S2O7 مشاهده می شود. ظاهراً این دو ذره دو عامل اصلی الکتروفیلیک واقعی برای سولفوناسیون ترکیبات معطر در اسید سولفوریک آبی هستند. آنها را می توان به عنوان یک مولکول SO3 در نظر گرفت که به ترتیب با یون H3O + یا اسید سولفوریک هماهنگ شده است. هنگام حرکت از 85٪ به 100٪ اسید سولفوریک، غلظت یون H3O+ به شدت کاهش می یابد و غلظت H2SO4 افزایش می یابد. در 91% اسید =، اما از آنجایی که H2S2O7 (SO3. H2SO4) یک عامل الکتروفیل قویتر از H3SO4+ (H3O+ . SO3) است، نه تنها در 91٪، بلکه حتی در 85٪ اسید سولفوریک به عنوان یک الکتروفیل غالب است. بنابراین، مکانیسم سولفوناسیون ظاهراً می تواند به صورت زیر نمایش داده شود: اثر ایزوتوپ جنبشی kH/kD در غلظت اسید سولفوریک زیر 95 درصد ناچیز است. اما هنگامی که با 98-100٪ H2SO4 یا اولئوم سولفونه می شود، یک اثر ایزوتوپ جنبشی kH/kD در محدوده 1.15-1.7 مشاهده می شود، یعنی. مرحله (2) به مرحله تعیین کننده نرخ تبدیل می شود. هنگامی که غلظت اسید سولفوریک زیر 95٪ است، پروتون از کمپلکس توسط یون سولفات هیدروژن HSO4- جدا می شود و در غلظت های بالاتر اسید سولفوریک، H2SO4 خود نقش یک باز بسیار ضعیف را بازی می کند. بنابراین، سرعت مرحله (2) به شدت کاهش می یابد و یک اثر ایزوتوپ جنبشی مشاهده می شود. در اولئوم، سرعت سولفوناسیون به شدت افزایش می یابد. عامل الکتروفیل در این مورد، ظاهراً SO3 به یک کمپلکس متصل نیست. مرحله (2) کند است. آلکیلاسیون با توجه به فریدل کرافت. واکنش S. Friedel-J. Crafts (1877) یک روش مناسب برای معرفی مستقیم یک گروه آلکیل به یک حلقه معطر است. آلکیلاسیون ترکیبات معطر تحت اثر آلکیل هالیدها تنها در حضور یک اسید لوئیس مناسب به عنوان کاتالیزور انجام می شود: AlBr3، AlCl3، GaBr3، GaCl3، BF3، SbF5، SbCl5، FeCl3، SnCl4، ZnCl2 و غیره. فعال ترین کاتالیزورها آلومینیوم تصعید شده بی آب و برومیدهای گالیم، پنتا فلوراید آنتیموان، کلریدهای آلومینیوم و گالیم؛ هالیدهای آهن (III) و SbCl5 کمتر فعال هستند؛ کاتالیزورهای کم فعال شامل SnCl4 و ZnCl2 هستند. به طور کلی، فعالیت اسیدهای لوئیس به عنوان کاتالیزور برای آلکیلاسیون بنزن به ترتیب AlBr3> GaBr3> AlCl3> GaCl3> FeCl3> SbCl5> TiCl4> BF3> BCl3> SnCl4> SbCl3 کاهش می یابد. رایج ترین کاتالیزور برای این واکنش، کلرید آلومینیوم از پیش تصعید شده است. به عنوان مثال، مکانیسم واکنش بنزیلاسیون با بنزیل کلرید در نیتروبنزن در حضور AlCl3 بی آب به عنوان کاتالیزور به شرح زیر است: جایی که B: =AlCl4- ; H2O یا پایه دیگر. سرعت واکنش توسط مرحله دوم محدود می شود. ساختار دقیق واسطه (RCl .AlCl3) ناشناخته است. در اصل، طیف وسیعی از ساختارها را می توان تصور کرد، از کمپلکس های مولکولی تا کربوکاتیون های جدا شده. مشارکت کربوکاتیون های آزاد به عنوان عوامل آلکیله کننده بعید است. اگر آلکیلهکنندهها کربوکاتیونهای آزاد باشند، مرحله آهسته مرحله تشکیل آنها (k1) بوده و واکنش با آرنها سریع بوده و مرتبه سوم نباید مشاهده شود. بسیار بعید است که عامل آلکیله کننده یک کمپلکس مولکولی باشد. در دماهای پایین، گاهی اوقات می توان کمپلکس های آلکیل هالیدها را با اسیدهای لوئیس جدا کرد. آنها با تبادل آهسته هالوژن طبق طرح زیر مشخص می شوند: نرخ ارز در سری R اولیه افزایش می یابد< втор.R<трет.R, что можно объяснить и ион-парным строением, и структурой координационного аддукта. بسیاری از محققانی که در این زمینه کار می کنند معتقدند که ساختار RX. MXn به تدریج از ساختار یک ترکیب اضافی هماهنگی در مورد R=CH3 به ساختار یک جفت یونی در مورد R=t-Bu تغییر می کند، اما این هنوز به طور تجربی تایید نشده است. توانایی اتم هالوژن در RX برای کمپلکس با AlCl3 یا اسید لوئیس سخت دیگر به شدت از فلوئور به ید کاهش می یابد، در نتیجه فعالیت آلکیل هالیدها به عنوان عوامل آلکیله کننده در واکنش Friedel-Crafts نیز به ترتیب RF کاهش می یابد. RCl> RBr> RI. به همین دلیل از آلکیل یدیدها به عنوان عامل آلکیله کننده استفاده نمی شود. تفاوت فعالیت بین آلکیل فلوریدها و آلکیل برومیدها به قدری زیاد است که امکان جایگزینی انتخابی فلوئور را در حضور برم در همان مولکول فراهم می کند. آیلاسیون فریدل کرافت معرفی یک گروه آسیل به یک حلقه معطر با استفاده از یک عامل اسیله کننده و یک اسید لوئیس، آسیلاسیون فریدل کرافت نامیده می شود. عوامل اسیله کننده معمولاً هالیدها و انیدریدهای اسید در حضور هالیدهای آلومینیوم، تری فلوراید بور یا پنتا فلوراید آنتیموان به عنوان اسیدهای لوئیس هستند. اسیل هالیدها و انیدریدهای اسید با اسید لوئیس کمپلکس های گیرنده دهنده با ترکیب 1:1 و 1:2 را تشکیل می دهند. با استفاده از روش های طیفی، مشخص شد که کلرید آلومینیوم، تری فلوراید بور و پنتا فلوراید آنتیموان در اتم اکسیژن کربونیل هماهنگ می شوند، زیرا از اتم کلر همسایه پایه ای تر است. عامل الکتروفیل در واکنش اسیلاسیون ترکیبات آروماتیک یا این کمپلکس دهنده-گیرنده یا کاتیون آسیلیوم است که بر اثر تفکیک آن ایجاد می شود. می توان فرض کرد که مرحله کند واکنش، حمله یکی از سه الکتروفیل (RCO+، RCOCl. AlCl3، RCOCl. Al2Cl6) به آرن است که منجر به -پیچیده اثربخشی این گونه های اسیله کننده به ماهیت بستر، آسیل هالید و حلال و همچنین مقدار کاتالیزور مورد استفاده بستگی دارد. در طی اسیلاسیون آرن ها با آسیل هالیدها که توسط کلرید آلومینیوم یا برمید در حلال های آپروتیک قطبی (نیتروبنزن، نیترو متان و غیره) کاتالیز می شوند، عامل آسیل کننده کاتیون آسیلیوم است، در حالی که در یک محیط کم قطب (متیلن کلرید، دی کلرو اتان یا تتر) ) یک کمپلکس دهنده-پذیرنده در واکنش شرکت می کند. ماهیت آسیل هالید نیز بر تشکیل و پایداری نمک های آسیلیوم تأثیر می گذارد. مکانیسم اسیلاسیون فریدل کرافت آرن ها تحت عمل کمپلکس دهنده-پذیرنده با نمودار زیر توضیح داده شده است: یک کتون آروماتیک یک باز لوئیس قوی تر از یک آسیل هالید است و یک کمپلکس پایدار با AlCl3 یا اسید لوئیس دیگر تشکیل می دهد. بنابراین، برای اسیلاسیون ترکیبات آروماتیک با آسیل هالیدها، مقدار هم مولار کمی بیشتر از کاتالیزور و برای اسیلاسیون با انیدریدهای اسیدی، دو مول کاتالیزور (از آنجایی که آنها حاوی دو اتم اکسیژن کربونیل هستند) مورد نیاز است. کتون با تجزیه کمپلکس خود با AlCl3 با آب یا اسید هیدروکلریک جدا می شود. آسیلاسیون فریدل کرافت کاملاً فاقد معایبی است که در واکنش آلکیلاسیون ذاتی است. در طول اسیلاسیون، تنها یک گروه آسیل معرفی میشود، زیرا کتونهای معطر بیشتر واکنش نشان نمیدهند (همانطور که سایر آرنهای حاوی گروههای قوی الکترونکشنده: NO2، CN، COOR) واکنش نشان نمیدهند. مزیت دیگر این واکنش در مقایسه با آلکیلاسیون عدم وجود بازآرایی در عامل اسیله کننده است. علاوه بر این، آسیلاسیون با واکنش های نامتناسب محصولات واکنش مشخص نمی شود. کتابشناسی - فهرست کتب واکنش مولکولی معطر جایگزینی 1.Kurts A.L.، Livantsov M.V.، Livantsova L.I. جایگزینی الکتروفیلیک در سری معطر: توسعه روش شناختی برای دانش آموزان سال سوم - مسکو، 1997. 2.Dneprovsky A.S. و دیگران مبانی نظری شیمی آلی/A.S. دنپروسکی، تی.آی. تمنیکووا: کتاب درسی برای دانشگاه ها - ویرایش دوم، تجدید نظر شده - L.: شیمی، 1961. - 560 ص. 3.ترنی آ. شیمی آلی مدرن جلد 1: کتاب درسی - میر، 1981.-680 ص. .Reutov O.A.، Kurts A.L.، Butin K.P. شیمی آلی: کتاب درسی - M.: MSU، 1999. - دهه 560 .سایکس پی. مکانیسمهای واکنش در شیمی آلی. مطابق. از انگلیسی ویرایش شده توسط پروفسور ورشاوسکی یا. ام. اد. سوم، م.، "شیمی"، 1977. - دهه 320.
پرکاربردترین واکنش بنزن، جایگزینی یک یا چند اتم هیدروژن توسط گروهی الکتروفیل است. بسیاری از مواد مهم از این طریق سنتز می شوند. انتخاب گروه های عاملی که می توان از این طریق به ترکیبات معطر وارد کرد بسیار گسترده است و علاوه بر این، برخی از این گروه ها می توانند پس از ورود به حلقه بنزن به گروه های دیگر تبدیل شوند. معادله کلی واکنش به صورت زیر است:
در زیر پنج مورد از رایج ترین واکنش ها از این نوع و نمونه هایی از استفاده از آنها آورده شده است.
نیتراسیون:

سولفوناسیون:
دیکیلاسیون Friedel-Crafts:
آسیلاسیون فریدل کرافت:
هالوژناسیون (فقط کلرزنی و برم زایی):

واکنش های زیر اغلب برای تبدیل بیشتر ترکیبات حاصل از جایگزینی الکتروفیل آروماتیک استفاده می شود.
ترمیم زنجیره جانبی:

کاهش گروه نیترو:

دیازوتیزاسیون و دگرگونی های بیشتر
آنیلین و جایگزین های آن می توانند به ترکیبات بسیار واکنش پذیری به نام نمک های دیازونیوم تبدیل شوند:

نمک های دیازونیوم به عنوان مواد اولیه برای سنتز طیف گسترده ای از ترکیبات معطر عمل می کنند (شکل 9-1). در بسیاری از موارد، روش سنتز نمک دیازونیوم تنها راه برای معرفی هر گروه عاملی به یک ترکیب معطر است.
جایگزینی گروه دیازونیوم با اتم های کلر و برم و همچنین با یک گروه سیانو با برهمکنش نمک های دیازونیوم با نمک های مس حاصل می شود (1). اتم های ید و فلوئور را نمی توان با هالوژناسیون مستقیم وارد حلقه آروماتیک کرد. یدیدهای معطر و فلوریدها به ترتیب با تیمار نمکهای دیازونیوم با یدید پتاسیم و هیدروفلوئوریک اسید تهیه می شوند.
اسیدهای کربوکسیلیک آروماتیک را می توان با هیدرولیز گروه نیتریل یا با اثر دی اکسید کربن روی معرف گریگنارد تهیه کرد (بیشتر در مورد این واکنش در فصل 12 بحث خواهد شد). فنل ها در آزمایشگاه اغلب با هیدرولیز نمک های دیازونیوم به دست می آیند.

نمودار 9-2. واکنش های نمک های دیازونیوم
گروه دیازونیوم (و بنابراین گروه آمینه و گروه نیترو) را می توان با عمل نمک های دیازونیوم اسید هیپوفسفر حذف کرد (یعنی با اتم هیدروژن جایگزین کرد).
در نهایت، برهمکنش نمک های دیازونیوم با ترکیبات معطر فعال شده منجر به تشکیل رنگ های آزو می شود. رنگ ها بسته به ماهیت جانشین های هر دو حلقه معطر می توانند رنگ های بسیار متفاوتی داشته باشند.
اسید نیتروژن که برای به دست آوردن نمک های دیازونیوم استفاده می شود، ماده ای کم پایدار است و در محل (یعنی مستقیماً در ظرف واکنش) از نیتریت سدیم و اسید هیدروکلریک تهیه می شود. در نمودار واکنش، تیمار با اسید نیتروژن را می توان به یکی از دو روش زیر نشان داد:

در اینجا چند نمونه از واکنش های نمک دیازونیوم آورده شده است:

تهیه مواد عملا مهم با استفاده از واکنش های جایگزینی الکتروفیل
رنگ ها.سنتز متیل اورنج در زیر نشان داده شده است. اگر ترکیبات اصلی را با جایگزین های دیگر در حلقه های معطر بگیرید، رنگ رنگ متفاوت خواهد بود.

پلیمرهاپلی استایرن از پلیمریزاسیون استایرن تولید می شود (به فصل 6 مراجعه کنید)، که به نوبه خود می تواند به شرح زیر سنتز شود. بنزن توسط Friedel-Crafts با استفاده از انیدرید استیک به جای استیل کلرید آسیله می شود، کتون حاصل به الکل احیا می شود و سپس با استفاده از هیدروژن سولفات پتاسیم به عنوان کاتالیزور اسیدی آبگیری می شود.

داروهادر سنتز سولفونامید (استرپتوسید)، دو مرحله اول واکنش هایی هستند که قبلاً با آنها روبرو شده ایم. مرحله سوم حفاظت از گروه آمینه است. این برای جلوگیری از تعامل اسید کلروسولفونیک با گروه آمینه ضروری است. پس از واکنش گروه با آمونیاک، گروه محافظ را می توان حذف کرد.

استرپتوساید یکی از اولین داروهای ضد میکروبی از گروه سولفونامیدها بود. امروزه نیز از آن استفاده می شود.
واکنشهای جایگزینی الکتروفیل امکان ورود گروههای مختلف را به حلقه معطر میدهد. بسیاری از این گروه ها می توانند در طول سنتز تبدیل شوند.
مکانیسم جایگزینی الکتروفیل معطر
مشخص شده است که جایگزینی الکتروفیل در ترکیبات معطر در دو مرحله انجام می شود. ابتدا یک الکتروفیل (که می تواند با روش های مختلف تولید شود) به حلقه بنزن اضافه می شود. در این حالت، یک کاتیون کربوهیدرات تثبیت شده تشدید شده تشکیل می شود (در زیر پرانتز). سپس این کاتیون یک پروتون را از دست می دهد و به یک ترکیب معطر تبدیل می شود.

در اینجا، برای وضوح، فرمول ترکیبات معطر با پیوندهای دوگانه نشان داده شده است. اما شما، البته، به یاد داشته باشید که در واقع ابری از الکترون های غیرمحلی وجود دارد.
مکانیسم های دو واکنش، از جمله مرحله تولید الکتروفیل، در زیر آورده شده است. هاوژناسیون
تولید الکتروفیل:
تعویض:

Friedel-Crafts acylation نسل الکتروفیل:

تعویض:

نفوذ نمایندگان
هنگامی که یک بنزن جایگزین با یک الکتروفیل واکنش می دهد، ساختار جایگزینی که قبلاً روی حلقه بنزن وجود دارد تأثیر قابل توجهی بر جهت گیری جانشینی و سرعت آن دارد.

بر اساس تأثیر آنها بر سرعت و جهت جانشینی الکتروفیل، همه جانشین های ممکن را می توان به سه گروه تقسیم کرد.
1. فعال کردن ارتوپاراگرا. در حضور جانشینی از این گروه در یک ترکیب معطر، سریعتر از بنزن جایگزین نشده واکنش نشان می دهد و الکتروفیل به سمت موقعیت های ارتو و پارا جانشین هدایت می شود و مخلوطی از بنزن های ارتو و پارا دی جایگزین تشکیل می شود. . این گروه شامل جایگزین های زیر است:

2. غیرفعال کردن متاگرایان. این جایگزین ها واکنش را در مقایسه با بنزن کاهش می دهند و الکتروفیل را به موقعیت متا هدایت می کنند. این گروه شامل:
3. ضدعفونی کننده ارتو، پارا اورینانت. این گروه شامل اتم های آلوژن است.
نمونه هایی از جهت گیری برای جایگزینی الکتروفیل:


توضیح تأثیر جانشین ها
چرا جانشین های مختلف اثرات متفاوتی بر ماهیت جایگزینی الکتروفیل دارند؟ پاسخ به این سوال را می توان با تجزیه و تحلیل پایداری واسطه های تشکیل شده در هر مورد به دست آورد. برخی از این کربوکاتیون های میانی پایدارتر و برخی دیگر پایدارتر خواهند بود. به یاد بیاورید که اگر یک ترکیب بتواند به چندین روش واکنش نشان دهد، واکنش در مسیری پیش می رود که پایدارترین واسطه را تولید می کند.
در زیر ساختارهای تشدید ذرات میانی ایجاد شده در طی حمله الکتروفیلیک کاتیون در موقعیتهای ارتو و پارا فنل، که دارای یک جایگزین فعال کننده قدرتمند است - ارتو، پاراگرا، تولوئن، که دارای یک جایگزین با همان است، نشان داده شده است. ، اما خواص بسیار ضعیف تر، و نیتروبنزن، که در آن گروه نیترو یک عامل جهت دهنده است و حلقه را غیرفعال می کند:

هنگامی که یک الکتروفیل به هر دو موقعیت ارتو و پارا فنل حمله می کند، ساختارهای تشدید بیشتری را می توان برای واسطه به دست آمده نسبت به واسطه متا جایگزینی نوشت. علاوه بر این، این ساختار "اضافی" (که در یک قاب دایره شده است) سهم بزرگی دارد
در تثبیت کاتیون، زیرا همه اتم های موجود در آن یک هشت الکترون دارند. بنابراین، با حمله ارتو یا پاراگرا یک الکتروفیل، کاتیون پایدارتری نسبت به حمله در موقعیت متا ظاهر میشود، بنابراین جانشینی عمدتاً در موقعیتهای ارتو و پارا انجام میشود. از آنجایی که کاتیون حاصل از چنین جایگزینی پایدارتر از کاتیون تشکیل شده از بنزن جایگزین نشده است، فنل بسیار راحت تر از بنزن تحت واکنش های جایگزینی الکتروفیلیک قرار می گیرد. توجه داشته باشید که همه جانشینهایی که حلقه معطر را در واکنشهای جایگزینی الکتروفیل به شدت یا متوسط فعال میکنند دارای یک اتم مرتبط با حلقه با جفتهای تک الکترون هستند. این الکترون ها می توانند وارد حلقه شوند. در این مورد، یک ساختار تشدید با بار مثبت روی یک اتم الکترونگاتیو (اکسیژن یا نیتروژن) ظاهر می شود. همه اینها واسطه را تثبیت می کند و سرعت واکنش را افزایش می دهد (فعال سازی رزونانس).
در مورد تولوئن، جایگزینی در هر دو موقعیت ارتو و d منجر به کاتیون پایدارتری نسبت به زمانی که الکتروفیل به موقعیت متا حمله می کند، می شود.

در ساختارهای رزونانس جعبه ای، بار مثبت روی اتم های کربن سوم است (کربوکاتیون های سوم، به فصل 5 مراجعه کنید). هنگام حمله به موقعیت متا، هیچ کربوکاتیون سومی تشکیل نمی شود. در اینجا دوباره، جایگزینی ارتو و پارا از طریق گونههای میانی کمی پایدارتر از متاجانشینی و از جانشینی در خود بنزن میگذرد. بنابراین، جایگزینی در تولوئن به سمت موقعیت ارتو و پارا هدایت می شود و تا حدودی سریعتر از جایگزینی در لیزول (فعال شدن به دلیل اثر القایی) انجام می شود.
همه گروه های غیرفعال کننده، از جمله گروه نیترو، دارای خاصیت خروج الکترون ها از حلقه آروماتیک هستند. نتیجه این امر بی ثباتی کاتیون میانی است. بخصوص

(برای مشاهده اسکن کلیک کنید)
واسطه های ناشی از حمله در موقعیت های ارتو و پارا به شدت بی ثبات می شوند، زیرا بار مثبت جزئی بلافاصله در کنار گروه نیترو قرار دارد (ساختارهای تشدید مربوطه در جعبه هستند). بنابراین، جایگزینی متا بر جایگزینی ارتو و پارا ترجیح داده می شود. نیتروبنزن بسیار دشوارتر از بنزن جایگزین الکتروفیل می شود، زیرا چگالی الکترون در حلقه کاهش می یابد و جاذبه متقابل حلقه آروماتیک و الکتروفیل ضعیف می شود.

واکنش های افزودن الکتروفیلی در دو مرحله از طریق تشکیل یک کاتیون میانی رخ می دهد. جانشینهای مختلف روی حلقه بنزن اثرات متفاوتی بر نرخهای جایگزینی و جهتگیری دارند. این اثر را می توان با در نظر گرفتن پایداری واسطه های تشکیل شده در هر مورد توضیح داد.

واکنشهای جایگزینی الکتروفیل نسبت به بنزن دشوارتر است، که به دلیل اثر قوی الکترونکشی گروه نیترو است. جایگزینی در موقعیت متا رخ می دهد، زیرا گروه نیترو یک جهت گیری نوع II است (S E 2 arom).
بنابراین، واکنشهای جایگزینی الکتروفیل تنها با معرفهای قوی (نیتراسیون، سولفوناسیون، هالوژناسیون) در شرایط سختتر انجام میشود:

واکنش های جایگزینی هسته دوست
در واکنش های جانشینی نوکلئوفیل (S N 2 arom)، گروه نیترو هسته دوست را به سمت موقعیت های ارتو و پارا هدایت می کند.
به عنوان مثال، ادغام نیتروبنزن با KOH در 100 درجه سانتیگراد منجر به تولید ارتو و پارا نیتروفنول می شود:

حمله به موقعیت ارتو ترجیح داده می شود، زیرا اثر القایی منفی گروه نیترو، که در فاصله کوتاه عمل می کند، کمبود بیشتری از الکترون ها در ارتو نسبت به موقعیت پارا ایجاد می کند.
حضور دو و به خصوص سه گروه نیترو در یک موقعیت متا نسبت به یکدیگر باعث افزایش بیشتر واکنشها با معرفهای نوکلئوفیل میشود.
برای مثال، هنگامی که متا دینیتروبنزن با یک قلیایی یا با آمید سدیم واکنش میدهد، یکی از اتمهای هیدروژن واقع در موقعیتهای ارتو یا پارا با یک گروه جایگزین میشود. اوه،یا در N.H. 2 :

2،4-دی نیتروفنول

2،6-دینیتروآنیلین
تری نیتروبنزن متقارن با قلیایی واکنش می دهد و اسید پیکریک را تشکیل می دهد:

2،4،6-ترینیتروفنول
اسید پیکریک
تأثیر گروه نیترو بر واکنش پذیری
گروه های دیگر در حلقه بنزن
جایگزینی هسته دوست از گروه نیترو
اگر گروههای نیترو در موقعیتهای ارتو و پارا نسبت به یکدیگر باشند، یکدیگر را فعال میکنند و با خروج یون نیتریت، جایگزینی هستهدوست گروه نیترو امکانپذیر است:


جایگزینی هسته دوست هالوژن ها و سایر گروه ها
گروه نیترو جایگزینی هسته دوست نه تنها اتم هیدروژن، بلکه سایر گروه های واقع در حلقه بنزن را در موقعیت های ارتو و پارا نسبت به گروه نیترو فعال می کند.
اتم های هالوژن، -OH، -OR، -NR 2 و سایر گروه ها به راحتی توسط هسته دوست ها جایگزین می شوند.
نقش گروه نیترو نه تنها ایجاد بار مثبت بر روی اتم کربن مرتبط با گروه جایگزین شده، بلکه برای تثبیت کمپلکس ϭ منفی است، زیرا گروه نیترو باعث جابجایی بار منفی می شود.
به عنوان مثال، هالوژن در ارتو- و پارا-نیتروکلروبنزن ها تحت تأثیر گروه نیترو به راحتی با ذرات نوکلئوفیل جایگزین می شود:


:Nu: -- = او -- ، N.H. 2 -- ، من -- , -- OCH 3
وجود دو و به خصوص سه گروه نیترو، جایگزینی نوکلئوفیل را تسریع میکند، و این در مواردی که گروههای نیترو در موقعیت ارتو یا پارا نسبت به گروه جایگزین قرار دارند، بیشتر آشکار میشود:

2،4-دی نیتروکلروبنزن
اتم هالوژن به راحتی در 2،4،6-ترینیتروکلروبنزن (پیکریل کلرید) جایگزین می شود:

2،4،6-ترینیتروکلروبنزن
(پیکریل کلرید)
واکنش های مربوط به تحرک اتم های هیدروژن
رادیکال های آلکیل
گروه نیترو به دلیل خاصیت الکترون کشش قوی خود، تأثیر قابل توجهی بر تحرک اتم های هیدروژن رادیکال های آلکیل واقع در موقعیت های ارتو و پارا نسبت به آن دارد.
الف) واکنش های تراکم با آلدهیدها
در پارا نیتروتولوئن، اتم های هیدروژن گروه متیل، تحت تأثیر گروه نیترو، تحرک بالایی به دست می آورند و در نتیجه، پارا نیتروتولوئن به عنوان یک جزء متیلن وارد واکنش های تراکمی با آلدهیدها می شود:

ب) تشکیل اسیدهای نیترونیک
اتم های هیدروژن در اتم α-کربن، به دلیل ترکیب ϭ,π، تحرک بالایی دارند و می توانند به اکسیژن گروه نیترو مهاجرت کنند تا اسید نیترونیک تومریک تشکیل دهند.
تشکیل اسیدهای نیترونیک در ترکیبات نیترو معطر با یک گروه نیترو در حلقه با تبدیل حلقه بنزن به ساختار کینوئیدی همراه است:
به عنوان مثال، ارتو-نیتروتولوئن فتوکرومیسم را نشان می دهد: یک اسید نیترونیک آبی روشن تشکیل می شود (ساختارهای کینوئید اغلب به شدت رنگ می شوند:

ارتو-نیتروتولوئن نیترونیک اسید
برای واکنش های جایگزینی الکتروفیل اس Eمعمولیترین گروهها، گروههایی هستند که میتوانند در حالتی با پوسته ظرفیت پر نشده وجود داشته باشند.
چنین گروهی می تواند یک پروتون باشد، اما تحرک آن به اسیدیته بستگی دارد. در آلکان های اشباع، هیدروژن غیر فعال است. جانشینی هیدروژن در موقعیتهایی که به اندازه کافی اسیدی است، آسانتر اتفاق میافتد، برای مثال، موقعیت به گروه کربونیل، یا پروتون در پیوند استیلن. نوع مهم واکنش اس Eشکاف آنیونی است که شامل بریدن پیوند کربن-کربن است که گروه ترک آن کربن است. به خصوص مستعد واکنش هستند اس Eترکیبات آلی فلزی
مکانیسم های جایگزینی الکتروفیل آلیفاتیک
مکانیسم آلیفاتیک اس Eبر خلاف اس نبه اندازه کافی مطالعه نشده است. چهار نوع مکانیسم وجود دارد اس E : اس E 1, اس E 2 (از پشت)، اس E 2 (از جلو) اس من. مکانیسم دو مولکولی اس Eمشابه اس ن 2 به این معنا که همزمان با گسیختگی اتصال قدیم، یک ارتباط جدید شکل می گیرد. با این حال، یک تفاوت قابل توجه وجود دارد.
که در اس ن 2، هسته دوست با جفت الکترون خود نزدیک می شود و از آنجایی که جفت الکترون ها یکدیگر را دفع می کنند، فقط می تواند از پشت به جفت الکترون خروجی نزدیک شود. در جایگزینی الکتروفیلیک، یک اوربیتال خالی می تواند یا از عقب، جذب یک جفت الکترون، یا از جلو نزدیک شود. بنابراین، دو مکانیسم ممکن از لحاظ نظری در نظر گرفته شده است.
S E 2 (از جلو)
S E 2 (از عقب)
مکانیسم دو مولکولی سومی وجود دارد اس E، زمانی که بخشی از مولکول الکتروفیل با ایجاد پیوند با آن، جداسازی گروه ترک را تقویت می کند. این مکانیسم S نامیده می شود من .
شواهد: مکانیسم ها اس E 2 و اس منتشخیص آسان نیست همه آنها با سینتیک مرتبه دوم مطابقت دارند. اس منو اس E 2 (از جلو) با حفظ پیکربندی ادامه دهید. اس E 2 (از عقب) با معکوس کردن پیکربندی ادامه می یابد. تایید مکانیسم اس E 2 (از جلو) این است که جایگزینی الکتروفیل می تواند در اتم های کربن در سر پل رخ دهد.
مکانیسم تک مولکولی جایگزینی الکتروفیل اس E 1 مشابه است اس ن 1 و شامل دو مرحله یونیزاسیون آهسته و نوترکیب سریع می باشد.

شواهد مکانیزم اس E 1. یکی از اثبات ها سینتیک مرتبه اول زیرلایه است. شواهد استریوشیمیایی در واکنش مهم است:
تبادل یک پروتون با دوتریوم با همان سرعت راسمی شدن اتفاق می افتد و یک اثر ایزوتوپ جنبشی مشاهده می شود. واکنش اس ن 1 در سر پل رخ نمی دهد، اما اس E 1 به راحتی پیش می رود، که از آن نتیجه می شود که کاربانیون لازم نیست صاف باشد، می تواند ساختاری هرمی داشته باشد.
هنگام انجام جایگزینی الکتروفیلیک با یک بستر آلیلیک، محصول بازآرایی را می توان به دست آورد:
این نوع فرآیند مشابه است اس نو می تواند دو راه را طی کند.
اولین مورد از طریق تشکیل یک آللیک کربنیون واسطه رخ می دهد:
مسیر دوم شامل افزودن الکتروفیلیک در یک پیوند دوگانه با تشکیل میانی کربوکاتیون و حذف بعدی الکتروفیوژ است:
مهمترین واکنشهای جایگزینی الکتروفیل آلیفاتیک
واکنش اسیدهای CH
اگر در واکنشهای جانشینی الکتروفیل گروه خروجی هیدروژن باشد که به شکل پروتون حذف میشود، به این گونه سوبستراها اسیدهای CH میگویند. مهمترین واکنش های این نوع به دنبال مکانیسم اس E 1 :
تبادل ایزوتوپ هیدروژن
 ;
;
مهاجرت اوراق دو و سه گانه

- ترکیب با نمک های دیازونیوم

در یک محیط فوق اسیدی، جایگزینی هیدروژن می تواند طبق مکانیسم انجام شود اس E 2 از طریق تشکیل یون های کربنیوم:
واکنش ترکیبات آلی فلزی
واکنش های اصلی ترکیبات آلی فلزی عبارتند از: فلزات اولیه، هالید دمفلزی شدن و ترانس فلزی شدن.
پروتو فلز زداییواکنش جایگزینی یک فلز در یک ترکیب آلی فلزی با هیدروژن تحت اثر اسیدها است
هالیددمتالاسیونواکنش های جایگزینی فلز با هالوژن تحت تأثیر هالوژن ها یا اینترهالوژن ها نامیده می شود:
فلزسازی مجددواکنش مبادله یک فلز با فلز دیگر نامیده می شود. هم یک نمک فلزی غیر آلی و هم یک ترکیب آلی فلزی می توانند به عنوان یک ماده جایگزین عمل کنند:
واکنشهای مربوط به شکست پیوند کربن-کربن هترولیتیک
واکنشهایی که با جدا شدن پیوند کربن-کربن رخ میدهند، به نام شکاف آنیونی، اغلب از طریق مکانیسم رخ میدهند. اس E 1 با تشکیل متوسط کربنیون:

واکنش های تقسیم آنیون به طور معمول به دو گروه تقسیم می شوند. گروه اول شامل فرآیندهایی است که در آن ترکیبات کربونیل به عنوان گروه ترک عمل می کنند. بستر این واکنش ترکیبات حاوی هیدروکسیل است. مهم ترین واکنش های این گروه عبارتند از: واکنش رتروآلدول، برش سیانوهیدرین ها، برش الکلات های سوم. گروه دوم از واکنش های برش آنیونی، شکاف آسیل نامیده می شود، زیرا الکتروفیوژ به شکل کربوکسیلیک اسید یا مشتق آن شکافته می شود. سوبستراهای این گروه ترکیبات کربونیل هستند و فرآیند با افزودن هسته دوست یک باز به گروه کربونیل آغاز می شود:

مهم ترین واکنش های این نوع عبارتند از: برش بتا کتواسترها و بتا دیکتون ها (شکاف اسیدی تحت تاثیر بازها)، واکنش هالوفرم، واکنش های دکربوکسیلاسیون نمک های اسید کربوکسیلیک.
- خرید مشترک اسباب بازی Polesie با قیمت خرید مشترک اسباب بازی برای کودکان
- خواهر میلیونر متوفی: "جیگوردا میلیون ها لیودمیلا را دریافت نخواهد کرد.
- تعیین اینکه اقامه دعوی در کدام دادگاه صحیح است
- کمک مالی برای یک دانشجو
- غرامت در ازای شیر: مبنای قانونی برای پرداخت و مالیات (لارینا ن
- حداکثر بهره وام در فدراسیون روسیه
- اسناد اولیه برای حسابداری دارایی های ثابت
- بدهی ها در فعالیت های یک شرکت: تعریف و تجزیه و تحلیل
- تعیین هزینه های لازم برای تامین نیروی کار سازمان
- ضریب دهک چقدر است؟
- روش های محاسبه کاهش هزینه محصول نحوه تعیین درصد کاهش هزینه
- ویژگی های دانشجویی که در حال گذراندن دوره کارآموزی در یک شرکت است: قوانین نوشتن مشخصات نمونه پس از اتمام دوره کارآموزی
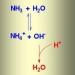
- آب آمونیاکی: تهیه، فرمول، کاربرد محاسبه جرم مولی
- تهیه گزارش معاینه شیمیایی پزشکی قانونی اماکن و تجهیزات
- واکنش های جایگزینی لیگاند مکانیسم جایگزینی لیگاند
- جایگزینی الکتروفیل در سیستم های آروماتیک
- معادلات تعادل مواد و حرارت معادله تعادل مواد
- شناسایی داروها با استفاده از طیف سنجی مادون قرمز نزدیک
- کد کار پاره وقت
- تنها بازمانده سقوط هواپیما در نزدیکی یاروسلاول دادگاه را غافلگیر کرد