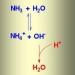
جایگزینی لیگاندها واکنش های جایگزینی لیگاند مکانیسم جایگزینی لیگاند
واکنش های جایگزینی، افزودن یا حذف لیگاندها که در نتیجه کره هماهنگی فلز تغییر می کند.
در یک مفهوم گسترده، واکنش های جایگزینی به معنای فرآیندهای جایگزینی برخی لیگاندها در کره هماهنگی یک فلز با سایر لیگاندها است.
مکانیسم تجزیه (D). در حالت محدود، یک فرآیند دو مرحلهای از طریق یک واسطه با عدد هماهنگی کمتر انجام میشود:
ML6<->+ L; + Y --» ML5Y
مکانیسم انجمنی (A). یک فرآیند دو مرحله ای که با تشکیل یک واسطه با تعداد هماهنگی بزرگ مشخص می شود: ML6 + Y = ; =ML5Y+L
مکانیسم تبادل متقابل (I). بیشتر واکنش های مبادله ای از طریق این مکانیسم انجام می شود. این فرآیند یک مرحله ای است و با تشکیل یک واسطه همراه نیست. در حالت گذار، معرف و گروه ترک با مرکز واکنش مرتبط می شوند، وارد نزدیکترین کره هماهنگی آن می شوند و در طی واکنش یک گروه توسط گروه دیگر جابجا می شود، تبادل دو لیگاند رخ می دهد:
ML6 + Y = = ML5Y + L
مکانیزم داخلی این مکانیسم فرآیند جایگزینی لیگاند را در سطح مولکولی مشخص می کند.
2. ویژگی های خواص لانتانیدها (Ln) مرتبط با اثر فشرده سازی لانتانید. ترکیبات Ln 3+: اکسیدها، هیدروکسیدها، نمکها. سایر حالت های اکسیداسیون نمونه هایی از خواص کاهشی Sm 2+، Eu 2+ و خواص اکسید کننده Ce 4+، Pr 4+.
کاهش یکنواخت در شعاع اتمی و یونی هنگام حرکت در امتداد یک سری از عناصر 4f، فشرده سازی لانتانید نامیده می شود. من. این منجر به این واقعیت می شود که شعاع اتم های عناصر انتقالی 5d گروه چهارم (هافنیوم) و پنجم (تانتالوم) به دنبال لانتانیدها تقریباً برابر با شعاع آنالوگ های الکترونیکی آنها از دوره پنجم است: زیرکونیوم. و نیوبیم به ترتیب، و شیمی فلزات سنگین 4d و 5d مشترکات زیادی دارد. یکی دیگر از پیامدهای فشرده سازی f نزدیکی شعاع یونی ایتریوم به شعاع عناصر سنگین f است: دیسپروزیم، هولمیوم و اربیوم.
همه عناصر خاکی کمیاب اکسیدهای پایداری را در حالت اکسیداسیون +3 تشکیل می دهند. آنها پودرهای کریستالی نسوز هستند که به آرامی دی اکسید کربن و بخار آب را جذب می کنند. اکسیدهای اکثر عناصر از کلسینه کردن هیدروکسیدها، کربناتها، نیتراتها و اگزالاتها در هوا در دمای 800 تا 1000 درجه سانتیگراد به دست می آیند.
اکسیدهای M2O3 و هیدروکسیدهای M(OH)3 را تشکیل می دهند
فقط هیدروکسید اسکاندیم آمفوتریک است
اکسیدها و هیدروکسیدها به راحتی در اسیدها حل می شوند
Sc2O3 + 6HNO3 = 2Sc(NO3)3 + 3H2O
Y(OH)3 + 3HCl = YCl3 + 3H2O
فقط ترکیبات اسکاندیم در محلول آبی هیدرولیز می شوند
Cl3 ⇔ Cl2 + HCl
همه هالیدها در حالت اکسیداسیون +3 شناخته می شوند. همه نسوز هستند.
فلورایدها در آب کم محلول هستند. Y(NO3)3 + 3NaF = YF3↓+ 3NaNO3
لیگاندها یون ها یا مولکول هایی هستند که مستقیماً با عامل کمپلکس کننده در ارتباط هستند و اهداکننده جفت الکترون هستند. این سیستم های غنی از الکترون، که دارای جفت الکترون آزاد و متحرک هستند، می توانند اهداکننده الکترون باشند، به عنوان مثال: ترکیبات عناصر p خواص پیچیده سازی را نشان می دهند و به عنوان لیگاند در یک ترکیب پیچیده عمل می کنند. لیگاندها می توانند اتم و مولکول باشند
(پروتئین، اسیدهای آمینه، اسیدهای نوکلئیک، کربوهیدرات ها). کارایی و قدرت برهمکنش دهنده-گیرنده بین لیگاند و عامل کمپلکس کننده توسط قطبش پذیری آنها تعیین می شود - توانایی ذره برای تبدیل پوسته های الکترونی خود تحت تأثیر خارجی.
ثابت شکنندگی:
Knest= 2 /
به دهان=1/زانو
واکنش های جایگزینی لیگاند
یکی از مهمترین مراحل در کاتالیز کمپلکس فلزی - برهمکنش زیرلایه Y با کمپلکس - با سه مکانیسم انجام می شود:
الف) جایگزینی لیگاند با یک حلال. این مرحله معمولاً به عنوان تجزیه مجموعه به تصویر کشیده می شود
ماهیت فرآیند در بیشتر موارد جایگزینی لیگاند با حلال S است که سپس به راحتی با یک مولکول بستر Y جایگزین می شود.
ب) چسباندن لیگاند جدید در مختصات آزاد با تشکیل پیوند و به دنبال آن جداسازی لیگاند جایگزین شده
ج) جایگزینی همزمان (نوع S N 2) بدون تشکیل میانی
ایده هایی در مورد ساختار متالوآنزیم ها و سایر ترکیبات زیست کمپلکس (هموگلوبین، سیتوکروم ها، کوبالامین ها). اصول فیزیکوشیمیایی انتقال اکسیژن توسط هموگلوبین
ویژگی های ساختار متالوآنزیم ها.
ترکیبات بیوکمپلکس به طور قابل توجهی از نظر پایداری متفاوت هستند. نقش فلز در چنین مجتمع هایی بسیار خاص است: جایگزینی آن حتی با عنصری مشابه از نظر خواص منجر به از دست دادن قابل توجه یا کامل فعالیت فیزیولوژیکی می شود.
1. B12: حاوی 4 حلقه پیرول، یون کبالت و گروه CN- است. انتقال اتم H به اتم C را در ازای هر گروهی ترویج می کند، در فرآیند تشکیل دئوکسی ریبوز از ریبوز شرکت می کند.
2. هموگلوبین: ساختاری چهارتایی دارد. چهار زنجیره پلی پپتیدی که به هم متصل شده اند یک توپ تقریباً منظم را تشکیل می دهند که هر زنجیره با دو زنجیره در تماس است.
هموگلوبین- رنگدانه تنفسی که به خون رنگ قرمز می دهد. هموگلوبین از پروتئین و پورفیرین آهن تشکیل شده و اکسیژن را از اندام های تنفسی به بافت های بدن و دی اکسید کربن را از آن ها به اندام های تنفسی می رساند.
سیتوکروم ها- پروتئین های پیچیده (هموپروتئین ها) که انتقال گام به گام الکترون ها و/یا هیدروژن را از مواد آلی اکسید شده به اکسیژن مولکولی در سلول های زنده انجام می دهند. این ترکیب غنی از انرژی ATP را تولید می کند.
کوبالامین ها- ترکیبات ارگانوکبالت فعال بیولوژیکی طبیعی. اساس ساختاری K. حلقه کورین است که از 4 هسته پیرول تشکیل شده است که در آن اتم های نیتروژن به اتم کبالت مرکزی پیوند دارند.
اصول فیزیکوشیمیایی انتقال اکسیژن توسط هموگلوبین- اتم (Fe (II)) (یکی از اجزای هموگلوبین) قادر به تشکیل 6 پیوند هماهنگی است. از این تعداد، چهار مورد برای تثبیت خود اتم Fe(II) در هِم، پیوند پنجم برای اتصال هِم به زیرواحد پروتئین، و پیوند ششم برای اتصال مولکول O2 یا CO2 استفاده می شود.
هموستاز فلز-لیگاند و دلایل اختلال آن. مکانیسم اثر سمی فلزات سنگین و آرسنیک بر اساس تئوری اسیدها و بازهای سخت و نرم (HSBA). اصول ترمودینامیکی کیلیت درمانی مکانیسم اثر سیتوتوکسیک ترکیبات پلاتین
در بدن، تشکیل و تخریب بیوکمپلکسهای کاتیونهای فلزی و بیولیگاندها (پورفینها، اسیدهای آمینه، پروتئینها، پلی نوکلئوتیدها) که شامل اتمهای اهداکننده اکسیژن، نیتروژن و گوگرد است، بهطور مداوم رخ میدهد. تبادل با محیط، غلظت این مواد را در یک سطح ثابت نگه می دارد و فلز را فراهم می کند لیگاند هموستاز. نقض تعادل موجود منجر به تعدادی از پدیده های پاتولوژیک - حالت های بیش از حد فلز و کمبود فلز می شود. به عنوان مثال، میتوانیم فهرست ناقصی از بیماریهای مرتبط با تغییرات در تعادل فلز-لیگاند را برای تنها یک یون - کاتیون مس، ذکر کنیم. کمبود این عنصر در بدن باعث ایجاد سندرم منکس، سندرم مورفان، بیماری ویلسون کونوالوف، سیروز کبدی، آمفیزم ریوی، آئورت و آرتریوپاتی، کم خونی می شود. مصرف بیش از حد کاتیون می تواند منجر به یک سری بیماری های اندام های مختلف شود: روماتیسم، آسم برونش، التهاب کلیه ها و کبد، انفارکتوس میوکارد و غیره که هیپرکوپرمی نامیده می شود. هیپرکوپروز شغلی نیز شناخته شده است - تب مس.
گردش فلزات سنگین تا حدی به شکل یون یا کمپلکس با اسیدهای آمینه و اسیدهای چرب انجام می شود. با این حال، نقش اصلی در انتقال فلزات سنگین متعلق به پروتئین هایی است که پیوندهای قوی با آنها ایجاد می کنند.
آنها به غشای سلولی ثابت می شوند و گروه های تیول پروتئین های غشایی را مسدود می کنند– 50 درصد آن ها پروتئین های آنزیمی هستند که پایداری کمپلکس های پروتئینی- لیپیدی غشای سلولی و نفوذپذیری آن را مختل کرده و باعث آزاد شدن پتاسیم از سلول و نفوذ سدیم و آب به داخل آن می شوند.
چنین تأثیری از این سموم که به طور فعال بر روی گلبول های قرمز تثبیت می شوند، منجر به اختلال در یکپارچگی غشای گلبول های قرمز، مهار فرآیندهای گلیکولیز هوازی و متابولیسم در آنها به طور کلی و تجمع پراکسید هیدروژن فعال همولیتیک می شود. به ویژه مهار پراکسیداز، که منجر به ایجاد یکی از علائم مشخصه مسمومیت با ترکیبات این گروه می شود - همولیز.
توزیع و رسوب فلزات سنگین و آرسنیک تقریباً در همه اندام ها اتفاق می افتد. قابل توجه ویژه توانایی این مواد برای تجمع در کلیه ها است، که با محتوای غنی گروه های تیول در بافت کلیه، وجود پروتئین در آن - متالوبیونین، حاوی تعداد زیادی از گروه های تیول، توضیح داده می شود. به رسوب طولانی مدت سموم. بافت کبد که همچنین غنی از گروه های تیول است و حاوی متالوبیونین است نیز با تجمع بالای ترکیبات سمی این گروه مشخص می شود. دوره سپرده گذاری، به عنوان مثال، جیوه می تواند به 2 ماه یا بیشتر برسد.
انتشار فلزات سنگین و آرسنیک به نسبت های مختلف از طریق کلیه ها، کبد (با صفرا)، غشای مخاطی معده و روده ها (با مدفوع)، عرق و غدد بزاقی، ریه ها که معمولاً با آسیب به دستگاه دفع همراه است، صورت می گیرد. این اندام ها و با علائم بالینی مربوطه آشکار می شود.
دوز کشنده برای ترکیبات جیوه محلول 0.5 گرم، برای کالامل 1-2 گرم، برای سولفات مس 10 گرم، برای استات سرب 50 گرم، برای سرب سفید 20 گرم، برای آرسنیک 0.1-0.2 گرم است.
غلظت جیوه در خون بیش از 10 میکروگرم در لیتر (1γ%)، در ادرار بیش از 100 میکروگرم در لیتر (10γ%)، غلظت مس در خون بیش از 1600 میکروگرم در لیتر (160 γ٪) است. آرسنیک بیش از 250 میکروگرم در لیتر (25γ) در ادرار است.
کیلات تراپی حذف ذرات سمی است
از بدن، بر اساس کیلاسیون آنها
ترکیبات عناصر s
داروهای مورد استفاده برای حذف
مواد سمی موجود در بدن
ذرات سم زدا نامیده می شوند.
واکنش جایگزینی اصلی در محلول های آبی، مبادله مولکول های آب (22)، برای تعداد زیادی از یون های فلزی مورد مطالعه قرار گرفته است (شکل 34). مبادله مولکول های آب در کره هماهنگی یک یون فلزی با بخش عمده ای از مولکول های آب موجود به عنوان حلال برای اکثر فلزات بسیار سریع اتفاق می افتد و بنابراین سرعت چنین واکنشی را می توان عمدتاً با روش آرام سازی مطالعه کرد. این روش شامل برهم زدن تعادل سیستم، به عنوان مثال با افزایش شدید دما است. در شرایط جدید (دمای بالاتر)، سیستم دیگر در حالت تعادل نخواهد بود. سپس میزان تعادل اندازه گیری می شود. اگر می توانید دمای محلول را در داخل تغییر دهید 10-8 ثانیه، سپس می توانید سرعت واکنشی را اندازه گیری کنید که تکمیل آن به بیش از یک دوره زمانی نیاز دارد 10-8 ثانیه.
همچنین می توان سرعت جایگزینی مولکول های آب هماهنگ در یون های فلزی مختلف را با لیگاندهای SO 2-4، S 2 O 3 2-، EDTA و غیره اندازه گیری کرد (26). سرعت این واکنش
به غلظت یون فلزی هیدراته بستگی دارد و به غلظت لیگاند ورودی بستگی ندارد، که استفاده از معادله مرتبه اول (27) را برای توصیف سرعت این سیستم ها ممکن می سازد. در بسیاری از موارد، سرعت واکنش (27) برای یک یون فلزی معین به ماهیت لیگاند ورودی (L) بستگی ندارد، چه مولکول های H 2 O یا SO 4 2-، S 2 O 3 2-، یا یون های EDTA
این مشاهدات، همراه با این واقعیت که معادله سرعت برای این فرآیند شامل غلظت لیگاند ورودی نمیشود، نشان میدهد که این واکنشها با مکانیزمی انجام میشوند که در آن گام آهسته شامل شکستن پیوند بین یون فلز و آب است. ترکیب حاصل احتمالاً به سرعت لیگاندهای مجاور را هماهنگ می کند.
در بخش در 4 این فصل بیان شد که یونهای فلزی هیدراته با بار زیادتر، مانند Al 3+ و Sc 3+، مولکولهای آب را کندتر از یونهای M2+ و M+ تبادل میکنند. این دلیلی را برای این فرض فراهم می کند که شکستن اوراق قرضه نقش مهمی در مرحله ای دارد که نرخ کل فرآیند را تعیین می کند. نتایج بهدستآمده در این مطالعات قطعی نیست، اما دلیلی برای این باور است که فرآیندهای SN 1 در واکنشهای جایگزینی یونهای فلزی هیدراته مهم هستند.
احتمالاً مهمترین ترکیبات پیچیده مورد مطالعه، آمین های کبالت (III) هستند. پایداری، سهولت آمادهسازی و واکنشهای آهسته آنها را برای مطالعات جنبشی مناسب میسازد. از آنجایی که مطالعات این مجتمع ها منحصراً در محلول های آبی انجام شده است، ابتدا باید واکنش های این مجتمع ها با مولکول های حلال - آب را در نظر بگیریم. مشخص شد که به طور کلی، مولکولهای آمونیاک یا آمین هماهنگشده توسط یون Co(III) به آرامی با مولکولهای آب جایگزین میشوند که معمولاً جایگزینی لیگاندهایی غیر از آمینها در نظر گرفته میشود.
سرعت واکنشهای نوع (28) مورد مطالعه قرار گرفت و مشخص شد که نسبت به کمپلکس کبالت در درجه اول قرار دارد (X یکی از بسیاری از آنیونهای ممکن است).
از آنجایی که در محلول های آبی غلظت H 2 O همیشه تقریباً است 55.5 م، بنابراین تعیین تأثیر تغییر غلظت مولکول های آب بر سرعت واکنش غیرممکن است. معادلات سرعت (29) و (30) برای یک محلول آبی از نظر تجربی قابل تشخیص نیستند، زیرا k به سادگی برابر با k" = k" است. بنابراین، نمی توان از معادله سرعت واکنش تشخیص داد که آیا H2O در مرحله تعیین سرعت فرآیند شرکت خواهد کرد یا خیر. پاسخ به این سوال که آیا این واکنش با مکانیسم SN 2 با جایگزینی یون X توسط یک مولکول H 2 O یا مکانیسم S N 1، که ابتدا شامل تفکیک و سپس افزودن یک مولکول H 2 O است، ادامه می یابد، باید با استفاده از سایر داده های تجربی به دست آید.
این مشکل با دو نوع آزمایش قابل حل است. سرعت هیدرولیز (جایگزینی یک یون کلر در هر مولکول آب) ترنس- + تقریباً 10 3 برابر بیشتر از سرعت هیدرولیز 2+ است. افزایش بار کمپلکس منجر به استحکام پیوندهای فلز - لیگاند و در نتیجه جلوگیری از شکاف این پیوندها می شود. جذب لیگاندهای ورودی و تسهیل واکنش جایگزینی نیز باید در نظر گرفته شود. از آنجایی که با افزایش بار کمپلکس کاهش نرخ پیدا شد، در این مورد یک فرآیند تجزیه ای (SN 1) محتمل تر به نظر می رسد.
روش دیگر اثبات مبتنی بر مطالعه هیدرولیز مجموعه ای از مجتمع های مشابه است ترنس- + . در این کمپلکس ها، مولکول اتیلن دی آمین با دی آمین های مشابه جایگزین می شود که در آن اتم های هیدروژن در اتم کربن با گروه های CH 3 جایگزین می شوند. کمپلکس های حاوی دی آمین های جایگزین سریعتر از کمپلکس اتیلن دی آمین واکنش نشان می دهند. جایگزینی اتم های هیدروژن با گروه های CH 3 باعث افزایش حجم لیگاند می شود و حمله اتم فلز توسط لیگاند دیگر را دشوارتر می کند. این موانع فضایی واکنش را از طریق مکانیسم S N 2 کاهش می دهد. وجود لیگاندهای حجیم در نزدیکی اتم فلز فرآیند تجزیه را ارتقا می دهد، زیرا حذف یکی از لیگاندها تجمع آنها را در اتم فلز کاهش می دهد. افزایش مشاهده شده در سرعت هیدرولیز کمپلکس ها با لیگاندهای حجیم شواهد خوبی است که نشان می دهد واکنش مطابق با مکانیسم SN1 پیش می رود.
بنابراین، در نتیجه مطالعات متعدد روی کمپلکسهای اسیدوآمین Co(II)، مشخص شد که جایگزینی گروههای اسیدی با مولکولهای آب یک فرآیند تجزیهای در طبیعت است. پیوند اتم-لیگاند کبالت قبل از اینکه مولکولهای آب وارد مجتمع شوند تا یک مقدار بحرانی خاص گسترش مییابد. در کمپلکس هایی با بار 2+ و بالاتر، شکستن پیوند کبالت-لیگاند بسیار دشوار است و ورود مولکول های آب شروع به ایفای نقش مهم تری می کند.
مشخص شد که جایگزینی گروه اسیدی (X -) در کمپلکس کبالت (III) با گروهی غیر از مولکول H2O، (31) ابتدا جایگزین آن با یک مولکول می شود.
حلال - آب، به دنبال جایگزینی آن با یک گروه جدید Y (32).
بنابراین، در بسیاری از واکنش ها با کمپلکس های کبالت (III)، سرعت واکنش (31) برابر با سرعت هیدرولیز است (28). فقط یون هیدروکسیل از نظر واکنش پذیری با آمین های Co(III) با دیگر معرف ها متفاوت است. با توجه به نوع واکنش بسیار سریع با کمپلکس های آمین کبالت (III) (حدود 10 6 برابر سریعتر از آب) واکنش می دهد. هیدرولیز پایه (33).
این واکنش با توجه به لیگاند جایگزین OH - (34) مرتبه اول بود. مرتبه دوم کلی واکنش و پیشرفت غیرمعمول سریع واکنش نشان می دهد که یون OH یک معرف هسته دوست استثنایی برای کمپلکس های Co(III) است و این واکنش از طریق مکانیسم SN2 از طریق تشکیل یک واسطه انجام می شود.
با این حال، این خاصیت OH - را می توان با مکانیسم دیگری نیز توضیح داد [معادلات (35)، (36)]. در واکنش (35)، کمپلکس 2+ مانند یک اسید رفتار می کند (طبق گفته برونستد)، کمپلکس + را می دهد که آمیدو-(حاوی) -ترکیب - باز مربوط به اسید 2+.
سپس واکنش از طریق مکانیسم SN 1 (36) برای تشکیل یک حد واسط پنج مختصات ادامه می یابد، که بیشتر با مولکول های حلال واکنش می دهد تا محصول واکنش نهایی را تولید کند (37). این مکانیسم واکنش با سرعت یک واکنش مرتبه دوم مطابقت دارد و با مکانیسم SN 1 مطابقت دارد. از آنجایی که واکنش در مرحله تعیین سرعت شامل یک مزدوج باز به کمپلکس اصلی - اسید است، به این مکانیسم نام S N داده شده است. 1CB.
تعیین اینکه کدام یک از این مکانیسم ها مشاهدات تجربی را به بهترین شکل توضیح می دهد بسیار دشوار است. با این حال، شواهد قانع کننده ای برای حمایت از فرضیه S N 1CB وجود دارد. بهترین استدلالها به نفع این مکانیسم به شرح زیر است: کمپلکسهای هشتوجهی Co(III) عموماً از طریق مکانیسم تجزیهای SN1 واکنش نشان میدهند، و هیچ استدلال قانعکنندهای وجود ندارد که چرا یون OH- باید در فرآیند SN2 واسطه شود. ثابت شده است که یون هیدروکسیل یک معرف هسته دوست ضعیف در واکنش با Pt (II) است و بنابراین واکنش غیر معمول آن با Co (III) غیر منطقی به نظر می رسد. واکنشها با ترکیبات کبالت (III) در محیطهای غیر آبی شواهد بسیار خوبی برای تشکیل واسطههای مختصات پنجگانه ارائه شده توسط مکانیسم SN1 SV فراهم میکند.
اثبات نهایی این واقعیت است که در غیاب پیوندهای N-H در کمپلکس Co(III)، به آرامی با یون های OH- واکنش نشان می دهد. البته این نشان میدهد که ویژگیهای اسید-باز کمپلکس برای سرعت واکنش مهمتر از خواص هسته دوست OH است." اغلب می تواند به بیش از یک روش تفسیر شود، و برای حذف یک مکانیسم ممکن، لازم است یک آزمایش نسبتاً ظریف انجام شود.
در حال حاضر، واکنش های جایگزینی تعداد زیادی از ترکیبات هشت وجهی مورد مطالعه قرار گرفته است. اگر مکانیسم واکنش آنها را در نظر بگیریم، رایج ترین فرآیند تجزیه است. این نتیجه غیرمنتظره نیست زیرا شش لیگاند فضای کمی در اطراف اتم مرکزی باقی می گذارند تا گروه های دیگر به آن بچسبند. تنها چند نمونه وجود دارد که در آن وقوع یک واسطه هفت مختصات نشان داده شده است یا تأثیر یک لیگاند مداخله گر شناسایی شده است. بنابراین، مکانیسم SN2 را نمی توان به طور کامل به عنوان یک مسیر ممکن برای واکنش های جایگزینی در مجتمع های هشت وجهی رد کرد.
مراحل ابتدایی شامل هماهنگی و ترکیبات آلی فلزی در محلول ها و روی سطح فلزات و اکسیدهامراحل اولیه واکنشهای آلی که توسط اسیدها، بازها، کاتالیزورهای هسته دوست، کمپلکسهای فلزی، فلزات جامد و ترکیبات آنها در فرآیندهای ناهمگن و همگن فاز گاز یا فاز مایع کاتالیز میشوند، واکنشهای تشکیل و تبدیل انواع واسطههای آلی و آلی فلزی هستند. و همچنین مجتمع های فلزی. ترکیبات میانی آلی شامل یونهای کربنیم R+، کربنیم RH 2 +، کربن آنیونهای R-، کاتیونهای آنیون و رادیکال، رادیکالها و دو رادیکالهای R·, R: و همچنین مجتمعهای مولکولی مولکولهای دهنده و گیرنده آلی (DA)، که توسط کمپلکس های با انتقال بار نیز نامیده می شوند. در کاتالیز همگن و ناهمگن توسط کمپلکس های فلزی (کاتالیز کمپلکس فلزی) واکنش های آلی، واسطه ها ترکیبات پیچیده (هماهنگی) با لیگاندهای آلی و معدنی، ترکیبات آلی فلزی با پیوند M-C هستند که در بیشتر موارد ترکیبات هماهنگی هستند. وضعیت مشابهی در مورد شیمی "دو بعدی" روی سطح کاتالیزورهای فلز جامد رخ می دهد. اجازه دهید انواع اصلی واکنش های کمپلکس های فلزی و ترکیبات آلی فلزی را در نظر بگیریم.
مراحل ابتدایی شامل مجتمع های فلزیواکنش های کمپلکس های فلزی را می توان به سه گروه تقسیم کرد:
الف) واکنش های انتقال الکترون؛
ب) واکنش های جایگزینی لیگاند.
ج) واکنش لیگاندهای هماهنگ.
واکنش های انتقال الکترون
دو مکانیسم در واکنش های انتقال الکترون اجرا می شود - مکانیسم کره بیرونی (بدون تغییر در کره های هماهنگ کننده دهنده و گیرنده) و مکانیسم پل زدن (کره داخلی) که منجر به تغییر در کره هماهنگی فلز می شود.
اجازه دهید مکانیسم کره بیرونی را با استفاده از مثال مجتمع های هشت وجهی فلزات واسطه در نظر بگیریم. در مورد واکنش های متقارن ( جی 0 = 0)
ثابت های سرعت در طیف وسیعی از مقادیر متفاوت است - از 10-12 تا 105 لیتر در مول در ثانیه، بسته به پیکربندی الکترونیکی یون و درجه بازسازی آن در طول فرآیند. در این واکنش ها، اصل کمترین حرکت به وضوح آشکار می شود - کمترین تغییر در پوسته ظرفیت شرکت کنندگان واکنش.
در واکنش انتقال الکترون (1) (Co * ایزوتوپی از اتم Co است)
(واکنش متقارن)، Co 2+ (d 7) به Co 3+ (d 6) می رود. پیکربندی الکترونیکی (پوسته ظرفیت) در طول این انتقال تغییر نمی کند
6 الکترون در سطح پیوند انحطاط سه گانه بدون تغییر باقی می مانند () و از سطح آنتی پیوند ه gالکترون سطح یک حذف می شود.
ثابت سرعت مرتبه دوم برای واکنش (1) ک 1 = 1.1 lmol-1 sec-1. از آنجایی که فن (فنانترولین) یک لیگاند قوی است، حداکثر عدد 7 است د-الکترون ها جفت شده اند (حالت زوج اسپین). در مورد لیگاند ضعیف NH 3 وضعیت به طور اساسی تغییر می کند. Co(NH 3) n 2+ (n = 4، 5، 6) در حالت اسپین-جفت نشده (چرخش بالا) قرار دارد.
کمپلکس قویتر Co(NH 3) 6 3+ (قویتر از Co(NH 3) 6 2+ ~ 10 30 بار) در حالت جفت چرخشی است، مانند کمپلکس با Phen. در این راستا، در فرآیند انتقال الکترون، پوسته ظرفیت باید به شدت بازسازی شود و در نتیجه، ک= 10-9 lmol-1 sec-1. نرخ تبدیل Co 2+ به Co 3+ برابر 50 درصد در مورد لیگاند Phen در 1 ثانیه و در مورد NH 3 ~ در 30 سال به دست می آید. بدیهی است که مرحله ای با چنین سرعتی (به طور رسمی ابتدایی) می تواند از مجموعه مراحل ابتدایی در هنگام تجزیه و تحلیل مکانیسم های واکنش حذف شود.
اندازه جیبرای واکنش انتقال الکترون در طول تشکیل یک مجتمع برخورد، طبق نظریه مارکوس، شامل دو جزء و
اولین عبارت انرژی سازماندهی مجدد پیوندهای M-L در داخل مجموعه است (طول و قدرت پیوند زمانی که حالت ظرفیت تغییر می کند). مقدار شامل انرژی بازآرایی پوسته حلالیت بیرونی در فرآیند تغییر مختصات M-L و بار مجموعه است. هرچه تغییر در محیط الکترونیکی کوچکتر و تغییر در طول M-L کمتر باشد، لیگاندها بزرگتر، کوچکتر و در نتیجه سرعت انتقال الکترون بیشتر می شود. مقدار مورد کلی را می توان با استفاده از معادله مارکوس محاسبه کرد
جایی که. در = 0.
در مورد مکانیسم درون کره، فرآیند انتقال الکترون تسهیل می شود، زیرا یکی از لیگاندهای کمپلکس اول یک کمپلکس پل زدنی را با کمپلکس دوم تشکیل می دهد و یکی از لیگاندها را از آن جابجا می کند.
ثابتهای سرعت چنین فرآیندی 8 مرتبه بزرگتر از ثابتهای کاهش Cr(NH 3) 6 3+ هستند. در چنین واکنش هایی، عامل کاهنده باید یک کمپلکس حساس باشد و لیگاند موجود در عامل اکسید کننده باید قادر به تشکیل پل باشد (Cl-، Br-، I-، N 3 -، NCS-، bipy).
واکنش های جایگزینی لیگاندیکی از مهمترین مراحل در کاتالیز کمپلکس فلزی، برهمکنش زیرلایه Y با کمپلکس است که از طریق سه مکانیسم انجام می شود:
الف) جایگزینی لیگاند با یک حلال. این مرحله معمولاً به عنوان تجزیه مجموعه به تصویر کشیده می شود
ماهیت فرآیند در بیشتر موارد جایگزینی لیگاند L با حلال S است که سپس به راحتی با یک مولکول سوبسترای Y جایگزین می شود.
ب) چسباندن لیگاند جدید در مختصات آزاد با تشکیل پیوند و به دنبال آن جداسازی لیگاند جایگزین شده
ج) جایگزینی همزمان (نوع S N 2) بدون تشکیل میانی
در مورد کمپلکسهای Pt(II)، سرعت واکنش اغلب با معادله دو مسیری توصیف میشود
جایی که ک اسو ک Y- ثابت سرعت فرآیندهایی که در واکنش های (5) (با یک حلال) و (6) با لیگاند Y رخ می دهند.
آخرین مرحله از مسیر دوم مجموع سه مرحله ابتدایی سریع است - حذف Cl-، افزودن Y و حذف مولکول H 2 O.
در مجتمع های مربع مسطح فلزات واسطه، یک اثر ترانس مشاهده می شود که توسط I.I. Chernyaev فرموله شده است - تأثیر LT بر سرعت جایگزینی لیگاندی که در موقعیت ترانس به لیگاند LT است. برای کمپلکسهای Pt(II)، اثر ترانس در سری لیگاندها افزایش مییابد:
H2O~NH3< Cl- ~ Br- < I- ~ NO 2 - ~ C 6 H 5 - < CH 3 - <
< PR 3 ~ AsR 3 ~ H- < олефин ~ CO ~ CN-.
وجود اثر ترانس جنبشی و تأثیر ترمودینامیکی امکان سنتز کمپلکس های ایزومری بی اثر Pt(NH 3) 2 Cl 2 را توضیح می دهد:
واکنش لیگاندهای هماهنگ شده§ واکنش های جایگزینی الکتروفیل (SE) هیدروژن با یک فلز در کره هماهنگی فلز و فرآیندهای معکوس آنها
SH - H 2 O، ROH، RNH 2، RSH، ArH، RCCH.
حتی مولکول های H 2 و CH 4 در واکنش هایی از این نوع شرکت می کنند
§ واکنش های معرفی L از طریق اتصال M-X
در مورد X = R (کمپلکس آلی فلزی)، مولکول های هماهنگ فلزی نیز به پیوند M-R وارد می شوند (L - CO، RNC، C 2 H 2، C 2 H 4، N 2، CO 2، O 2 و غیره .). واکنش درج نتیجه حمله درون مولکولی هسته دوست X به مولکولی است که با نوع - یا - هماهنگ شده است. واکنش های معکوس - - و - واکنش های حذف
§ واکنش های افزودن اکسیداتیو و حذف کاهشی
M 2 (C 2 H 2 ) M 2 4 + ( C 2 H 2 ) 4-
ظاهراً در این واکنش ها همیشه هماهنگی اولیه مولکول اضافه شده وجود دارد، اما همیشه نمی توان آن را تشخیص داد. در این راستا، وجود یک سایت آزاد در کره هماهنگی یا یک سایت مرتبط با یک حلال که به راحتی با یک بستر جایگزین می شود، عامل مهمی بر واکنش پذیری کمپلکس های فلزی است. به عنوان مثال، کمپلکسهای بی آلیل نیکل، پیشسازهای خوبی برای گونههای فعال کاتالیزوری هستند، زیرا به دلیل حذف تقلیلی آسان بیآلیل، یک کمپلکس با حلال ظاهر میشود، به اصطلاح. نیکل "لخت". نقش صندلی های خالی با مثال زیر نشان داده شده است:
§ واکنش های افزودن هسته دوست و الکتروفیل به کمپلکس های فلزی - و -
واکنش ترکیبات آلی فلزیبه عنوان واسطههای واکنشهای کاتالیزوری، هم ترکیبهای آلی فلزی کلاسیک با پیوندهای M-C، M=C و MC وجود دارند و هم ترکیبات غیرکلاسیکی وجود دارند که در آنها لیگاند آلی مطابق با نوع 2، 3، 4، 5 و 6 هماهنگ شده است. ساختارهای یک عنصر دارای کمبود الکترون - پل زدن گروه های CH 3 و C 6 H 6، کاربیدهای غیر کلاسیک (Rh 6 C(CO) 16، C(AuL) 5 +، C(AuL) 6 2+، و غیره).
در میان مکانیسم های علمی برای ترکیبات آلی فلزی کلاسیک، چندین مکانیسم را ذکر می کنیم. بنابراین، 5 مکانیسم جایگزینی الکتروفیل اتم فلز در پیوند M-C ایجاد شده است.
جایگزینی الکتروفیلیک با کمک نوکلئوفیلیک
AdE Addition-Elimination
افزودن AdE(C) به اتم C در هیبریداسیون sp 2
AdE(M) افزودن اکسیداتیو به فلز
جایگزینی هسته دوست در اتم کربن در واکنش های فلز زدایی ترکیبات آلی فلزی به عنوان یک فرآیند اکسیداسیون- احیا رخ می دهد:
مشارکت احتمالی یک عامل اکسید کننده در این مرحله
چنین عامل اکسید کننده ای می تواند CuCl 2، p-benzoquinone، NO 3 - و سایر ترکیبات باشد. در اینجا دو مرحله ابتدایی دیگر مشخصه RMX وجود دارد:
هیدروژنولیز پیوند M-C
و همولیز پیوند M-C
قاعده مهمی که برای تمام واکنش های ترکیبات پیچیده و آلی فلزی اعمال می شود و با اصل حداقل حرکت همراه است، قانون پوسته الکترونی 16-18 تولمن است (بخش 2).
هماهنگی و ترکیبات آلی فلزیروی یک سطحبر اساس مفاهیم مدرن، کمپلکس ها و ترکیبات آلی فلزی مشابه ترکیبات موجود در محلول ها بر روی سطح فلزات تشکیل می شوند. برای شیمی سطح، مشارکت چند اتم سطحی در تشکیل چنین ترکیباتی و البته عدم وجود ذرات باردار ضروری است.
گروه های سطحی می توانند هر اتم (H، O، N، C)، گروه های اتم (OH، OR، NH، NH 2، CH، CH 2، CH 3، R)، مولکول های هماهنگ CO، N 2، CO 2، C 2H4، C6H6. به عنوان مثال، در طول جذب CO بر روی یک سطح فلز، ساختارهای زیر پیدا شد:
مولکول C 2 H 4 بر روی سطح فلز با یک مرکز و پل های اتیلن دو متصل M-CH 2 CH 2 -M مجتمع می شود، یعنی. در اصل چرخه های فلزی
به عنوان مثال، در سطح Rh، در طول جذب اتیلن، فرآیندهای زیر تبدیل اتیلن با افزایش دما رخ می دهد:
واکنشهای واسطههای سطحی شامل مراحل افزودن اکسیداتیو، حذف احیاکننده، درج، - و - حذف، هیدروژنولیز پیوندهای M-C و C-C و سایر واکنشهای از نوع آلی فلزی، اما بدون ظاهر شدن یونهای آزاد است. جداول مکانیسم ها و واسطه های تبدیل سطحی هیدروکربن ها بر روی فلزات را نشان می دهد.
جدول 3.1. واکنش های کاتالیزوری شامل برش پیوند C-C.
نامگذاری ها:
آلکیل، متالاسیکل؛
کاربن، آلیل؛
کاربین، وینیل.
جدول 3.2. واکنش های کاتالیزوری شامل تشکیل پیوند C-C.
تعیین ها: جدول را ببینید. 3.1.
تشکیل تمامی ترکیبات آلی فلزی فوق بر روی سطح فلزات با روش های فیزیکی تایید شده است.
سوالاتی برای خودکنترلی
1) قانون کوچکترین تغییر در لایه ظرفیتی یک فلز چگونه در واکنش های انتقال الکترون خود را نشان می دهد؟
2) چرا جای خالی هماهنگی به تعامل موثر با بستر کمک می کند؟
3) انواع اصلی واکنش لیگاندهای هماهنگ را فهرست کنید.
4) مکانیسم های جایگزینی الکتروفیل در واکنش های ترکیبات آلی فلزی با NX را بیان کنید.
5) ترکیبات آلی فلزی سطحی را مثال بزنید.
6) نمونه هایی از مشارکت کمپلکس های سطحی کربن فلزی در تبدیل هیدروکربن ها را بیان کنید.
ادبیات برای مطالعه عمیق
1. Temkin O.N.، سینتیک واکنش های کاتالیزوری در محلول های مجتمع های فلزی، M.، MITHT، 1980، قسمت III.
2. Collman J., Higedas L., Norton J., Finke R., Organometallic Chemistry of Consumer Metals, M., Mir, 1989, vol. I, vol. II.
3. Moiseev I.I. - Complexes in oxidation of olefins, M., Nauka, 1970.
4. Temkin O.N., Shestakov G.K., Treger Yu.A., Acetylene: Chemistry. مکانیسم های واکنش ها فن آوری. م.، شیمی، 1991، 416 ص، بخش 1.
5. Henrici-Olivet G., Olive S., Coordination and catalysis, M., Mir, 1980, 421 p.
6. Krylov O.V.، Matyshak V.A.، ترکیبات واسطه در کاتالیز هتروژن، M.، Nauka، 1996.
7. Zaera F., An Organometallic Guide to the Chemistry of Hydrocarbon Moities on Transition Metal Surfaces., Chem. Rev., 1995, 95, 2651 - 2693.
8. Bent B.E.، تقلید جنبههای کاتالیز ناهمگن: تولید، جداسازی، و واکنش میانیهای سطحی پیشنهادی روی تک بلورها در خلاء، شیمی. Rev., 1996, 96, 1361 - 1390.
فصل 17. اتصالات پیچیده
17.1. تعاریف اساسی
در این فصل با گروه خاصی از مواد پیچیده به نام آشنا می شوید جامع(یا هماهنگی) اتصالات.
در حال حاضر، یک تعریف دقیق از مفهوم " ذره پیچیده"خیر معمولاً از تعریف زیر استفاده می شود.
به عنوان مثال، یک یون مس هیدراته 2 یک ذره پیچیده است، زیرا در واقع در محلول ها و برخی هیدرات های کریستالی وجود دارد، از یون های Cu 2 و مولکول های H 2 O تشکیل شده است، مولکول های آب مولکول های واقعی هستند و یون های Cu 2 در کریستال ها وجود دارند. از بسیاری از ترکیبات مس برعکس، یون SO 4 2 یک ذره پیچیده نیست، زیرا اگرچه یون O 2 در کریستال ها وجود دارد، یون S 6 در سیستم های شیمیایی وجود ندارد.
نمونه هایی از ذرات پیچیده دیگر: 2، 3، 2.
در همان زمان، یون های NH 4 و H 3 O به عنوان ذرات پیچیده طبقه بندی می شوند، اگرچه یون های H در سیستم های شیمیایی وجود ندارند.
گاهی اوقات ذرات پیچیده شیمیایی را ذرات پیچیده می نامند که تمام یا بخشی از پیوندها بر اساس مکانیسم دهنده - گیرنده تشکیل می شوند. در بیشتر ذرات پیچیده اینطور است، اما به عنوان مثال، در آلوم پتاسیم SO 4 در ذره پیچیده 3، پیوند بین اتم های Al و O در واقع طبق مکانیسم دهنده-پذیرنده تشکیل می شود و در ذره پیچیده وجود دارد. فقط یک برهمکنش الکترواستاتیک (یون-دوقطبی). وجود یک ذره پیچیده مشابه در ساختار در آلوم آهن آمونیوم، که در آن فقط برهمکنش یون-دوقطبی بین مولکول های آب و یون NH4 امکان پذیر است، تأیید می شود.
بر اساس بار آنها، ذرات پیچیده می توانند کاتیون، آنیون یا مولکول های خنثی باشند. ترکیبات پیچیده حاوی چنین ذرات می توانند به کلاس های مختلفی از مواد شیمیایی (اسیدها، بازها، نمک ها) تعلق داشته باشند. مثال ها: (H 3 O) یک اسید، OH یک باز، NH 4 Cl و K 3 نمک هستند.
به طور معمول عامل کمپلکس کننده اتمی از عنصری است که فلز را تشکیل می دهد، اما می تواند اتمی از اکسیژن، نیتروژن، گوگرد، ید و سایر عناصری باشد که غیرفلزات را تشکیل می دهند. حالت اکسیداسیون عامل کمپلکس می تواند مثبت، منفی یا صفر باشد. هنگامی که یک ترکیب پیچیده از مواد ساده تر تشکیل می شود، تغییر نمی کند.
لیگاندها می توانند ذراتی باشند که قبل از تشکیل یک ترکیب پیچیده، مولکول ها (H 2 O، CO، NH 3 و غیره)، آنیون ها (OH، Cl، PO 4 3، و غیره) و همچنین یک کاتیون هیدروژن بودند. . تمیز دادن بی هویتیا لیگاندهای تک دندانه (از طریق یکی از اتم هایشان به اتم مرکزی متصل می شوند، یعنی با یک پیوند)، دوشاخه(از طریق دو اتم آنها یعنی با دو پیوند به اتم مرکزی متصل می شوند) سه گانهو غیره.
اگر لیگاندها نامشخص باشند، تعداد هماهنگی برابر با تعداد این لیگاندها است.
CN به ساختار الکترونیکی اتم مرکزی، حالت اکسیداسیون آن، اندازه اتم مرکزی و لیگاندها، شرایط تشکیل ترکیب پیچیده، دما و عوامل دیگر بستگی دارد. CN می تواند مقادیری از 2 تا 12 داشته باشد. اغلب آن شش است، تا حدودی کمتر - چهار.
ذرات پیچیده ای با چندین اتم مرکزی وجود دارد.
دو نوع فرمول ساختاری ذرات پیچیده استفاده می شود: نشان دهنده بار رسمی اتم مرکزی و لیگاندها، یا نشان دادن بار رسمی کل ذره پیچیده. مثال ها:

برای مشخص کردن شکل یک ذره پیچیده، از مفهوم چند وجهی هماهنگی (چند وجهی) استفاده می شود.

چند وجهی هماهنگی همچنین شامل یک مربع (CN = 4)، یک مثلث (CN = 3) و یک دمبل (CN = 2) است، اگرچه این ارقام چند وجهی نیستند. نمونه هایی از چند وجهی هماهنگی و ذرات پیچیده با اشکال متناظر برای رایج ترین مقادیر CN در شکل نشان داده شده است. 1.
17.2. طبقه بندی ترکیبات پیچیده
به عنوان مواد شیمیایی، ترکیبات پیچیده به ترکیبات یونی تقسیم می شوند (گاهی اوقات به آنها می گویند یونی) و مولکولی ( غیر یونی) اتصالات ترکیبات کمپلکس یونی حاوی ذرات پیچیده باردار - یون - هستند و اسید، باز یا نمک هستند (به بند 1 مراجعه کنید). ترکیبات پیچیده مولکولی از ذرات پیچیده (مولکول) بدون بار تشکیل شده اند، به عنوان مثال: یا - طبقه بندی آنها به هر کلاس اصلی از مواد شیمیایی دشوار است.
ذرات پیچیده موجود در ترکیبات پیچیده کاملاً متنوع هستند. بنابراین، چندین ویژگی طبقه بندی برای طبقه بندی آنها استفاده می شود: تعداد اتم های مرکزی، نوع لیگاند، تعداد هماهنگی و موارد دیگر.
با توجه به تعداد اتم های مرکزیذرات پیچیده به دو دسته تقسیم می شوند تک هسته ایو چند هسته ای. اتم های مرکزی ذرات پیچیده چند هسته ای می توانند مستقیماً یا از طریق لیگاندها به یکدیگر متصل شوند. در هر دو مورد، اتم های مرکزی با لیگاندها یک کره داخلی واحد از ترکیب پیچیده را تشکیل می دهند:


بر اساس نوع لیگاندها، ذرات پیچیده به دو دسته تقسیم می شوند
1) مجتمع های آبی، یعنی ذرات پیچیده ای که در آنها مولکول های آب به صورت لیگاند وجود دارد. کمپلکس های آبی کاتیونی m کم و بیش پایدار هستند، کمپلکس های آبی آنیونی ناپایدار هستند. تمام کریستال هیدرات ها متعلق به ترکیبات حاوی کمپلکس های آبی هستند، به عنوان مثال:
Mg(ClO4) 2. 6H 2 O در واقع (ClO 4) 2 است.
BeSO 4. 4H 2 O در واقع SO 4 است.
روی (BrO 3) 2. 6H 2 O در واقع (BrO 3) 2 است.
CuSO4. 5H 2 O در واقع SO 4 است. H2O.
2) مجتمع های هیدروکسو، یعنی ذرات پیچیده ای که در آنها گروه های هیدروکسیل به صورت لیگاند وجود دارد که قبل از ورود به ترکیب ذره کمپلکس یون های هیدروکسید بودند، مثلاً: 2، 3، .
کمپلکس های هیدروکسو از کمپلکس های آبی تشکیل می شوند که خواص اسیدهای کاتیونیک را نشان می دهند:
2 + 4OH = 2 + 4H 2 O
3) آمونیاک، یعنی ذرات پیچیده ای که در آنها گروه های NH 3 به عنوان لیگاند (قبل از تشکیل یک ذره پیچیده - مولکول های آمونیاک) وجود دارند، به عنوان مثال: 2، 3.
آمونیاک را می توان از مجتمع های آبی نیز به دست آورد، به عنوان مثال:
2 + 4NH 3 = 2 + 4 H 2 O
رنگ محلول در این حالت از آبی به اولترامارین تغییر می کند.
4) کمپلکس های اسیدی، یعنی ذرات پیچیده ای که در آنها بقایای اسیدهای اسیدهای بدون اکسیژن و اسیدهای حاوی اکسیژن به عنوان لیگاند وجود دارند (قبل از تشکیل یک ذره پیچیده - آنیونها، به عنوان مثال: Cl, Br, I, CN, S 2, NO 2، S 2 O 3 2، CO 3 2، C 2 O 4 2، و غیره).
نمونه هایی از تشکیل کمپلکس های اسیدی:
جیوه 2 + 4I = 2
AgBr + 2S 2 O 3 2 = 3 + Br
واکنش اخیر در عکاسی برای حذف برمید نقره واکنش نداده از مواد عکاسی استفاده می شود.
(هنگام تولید فیلم عکاسی و کاغذ عکاسی، قسمتی از برمید نقره موجود در امولسیون عکاسی توسط سازنده کاهش نمی یابد. برای حذف آن، از این واکنش استفاده می شود (این فرآیند "تثبیت" نامیده می شود، زیرا برمید نقره حذف نشده است. به تدریج در نور تجزیه می شود و تصویر را از بین می برد)
5) مجتمع هایی که در آنها اتم های هیدروژن لیگاند هستند به دو گروه کاملاً متفاوت تقسیم می شوند: هیدریدمجتمع ها و مجتمع های موجود در ترکیب اونیماتصالات
در طول تشکیل کمپلکس های هیدرید - , , - اتم مرکزی یک گیرنده الکترون است و دهنده یون هیدرید است. حالت اکسیداسیون اتم های هیدروژن در این کمپلکس ها -1 است.
در کمپلکس های یونیم، اتم مرکزی یک دهنده الکترون است و گیرنده یک اتم هیدروژن در حالت اکسیداسیون +1 است. مثالها: H 3 O یا - یون اکسونیوم، NH 4 یا - یون آمونیوم. علاوه بر این، مشتقات جایگزینی از این یون ها وجود دارد: - یون تترمتیل آمونیوم، - یون تترافنیل لارسونیوم، - یون دی اتیلوکسونیوم و غیره.
6) کربونیلمجتمع ها - مجتمع هایی که در آنها گروه های CO به عنوان لیگاند وجود دارد (قبل از تشکیل کمپلکس - مولکول های مونوکسید کربن)، به عنوان مثال: , و غیره.
7) آنیون هالوژنهمجتمع ها - مجتمع های نوع .
بر اساس نوع لیگاندها، سایر کلاس های ذرات پیچیده نیز متمایز می شوند. علاوه بر این، ذرات پیچیده با انواع مختلف لیگاند وجود دارد. ساده ترین مثال کمپلکس آبی هیدروکسو است.
17.3. مبانی نامگذاری مرکب پیچیده
فرمول یک ترکیب پیچیده مانند فرمول هر ماده یونی تهیه می شود: فرمول کاتیون در وهله اول و آنیون در مرحله دوم نوشته می شود.
فرمول یک ذره مختلط در داخل پرانتز به ترتیب زیر نوشته می شود: ابتدا نماد عنصر سازنده کمپلکس قرار می گیرد، سپس فرمول لیگاندهایی که قبل از تشکیل کمپلکس کاتیون بوده اند، سپس فرمول لیگاندها قرار می گیرد. که قبل از تشکیل کمپلکس مولکول های خنثی بودند و بعد از آنها فرمول لیگاندها که قبل از تشکیل کمپلکس آنیون بودند.
نام یک ترکیب پیچیده مانند نام هر نمک یا باز ساخته می شود (اسیدهای پیچیده را نمک های هیدروژن یا اکسونیوم می نامند). نام ترکیب شامل نام کاتیون و نام آنیون است.
نام ذره مختلط شامل نام عامل کمپلکس کننده و نام لیگاندها می باشد (نام مطابق فرمول نوشته شده است اما از راست به چپ. برای عوامل کمپلکس کننده از نام روسی عناصر در کاتیون ها استفاده می شود. و لاتین در آنیون ها.
اسامی رایج ترین لیگاندها:
| H 2 O – آبی | کلر – کلرو | SO 4 2 - سولفاتو | OH - هیدروکسو |
| CO - کربونیل | Br – برومو | CO 3 2 - کربناتو | H – هیدریدو |
| NH 3 - آمین | NO 2 - نیترو | CN - سیانو | نه - نیتروزو |
| NO - نیتروزیل | O 2 – Oxo | NCS - تیوسیاناتو | H+I – هیدرو |
نمونه هایی از نام کاتیون های مختلط:
نمونه هایی از نام آنیون های پیچیده:
2- یون تتراهیدروکسوزینکات
3 - یون دی (تیوسولفاتو) آرژانتات (I).
3 - یون هگزاسیانوکرومات (III).
- یون تتراهیدروکسودیا کوآلومینات
- یون تترانیترودیامین کبالتات (III).
3 - یون پنتاسیانوآکوافرات (II).
نمونه هایی از نام ذرات پیچیده خنثی:
قوانین نامگذاری دقیق تر در کتاب های مرجع و کتابچه های راهنمای ویژه آورده شده است.
17.4. پیوندهای شیمیایی در ترکیبات پیچیده و ساختار آنها
در ترکیبات کمپلکس کریستالی با کمپلکسهای باردار، پیوند بین کمپلکس و یونهای کره بیرونی یونی است، پیوندهای بین ذرات باقیمانده کره خارجی بین مولکولی (از جمله هیدروژن) است. در ترکیبات کمپلکس مولکولی، ارتباط بین کمپلکس ها بین مولکولی است.
در بیشتر ذرات پیچیده، پیوندهای بین اتم مرکزی و لیگاندها کووالانسی هستند. همه آنها یا بخشی از آنها بر اساس مکانیسم اهداکننده - پذیرنده (در نتیجه - با تغییر در هزینه های رسمی) شکل می گیرند. در کمپلکسهای کمپایدار (مثلاً در کمپلکسهای آبی عناصر قلیایی و قلیایی خاکی و همچنین آمونیوم)، لیگاندها توسط جاذبه الکترواستاتیکی نگه داشته میشوند. پیوند در ذرات پیچیده اغلب پیوند دهنده - گیرنده یا پیوند هماهنگ نامیده می شود.
اجازه دهید شکل گیری آن را با استفاده از مثال آهن (II) aquacation در نظر بگیریم. این یون از واکنش تشکیل می شود:
FeCl 2cr + 6H 2 O = 2 + 2Cl
فرمول الکترونیکی اتم آهن 1 است س 2 2س 2 2پ 6 3س 2 3پ 6 4س 2 3د 6. بیایید نموداری از سطوح فرعی ظرفیت این اتم ترسیم کنیم:
هنگامی که یک یون با بار مضاعف تشکیل می شود، اتم آهن دو 4 را از دست می دهد س-الکترون:
یون آهن شش جفت الکترون اتم اکسیژن از شش مولکول آب را در اوربیتال های ظرفیت آزاد می پذیرد:

یک کاتیون پیچیده تشکیل می شود که ساختار شیمیایی آن را می توان با یکی از فرمول های زیر بیان کرد:

ساختار فضایی این ذره با یکی از فرمول های فضایی بیان می شود:

شکل چندوجهی هماهنگی هشت وجهی است. همه پیوندهای Fe-O یکسان هستند. فرض می شود sp 3 د 2 - هیبریداسیون AO اتم آهن. خواص مغناطیسی کمپلکس وجود الکترون های جفت نشده را نشان می دهد.
اگر FeCl 2 در محلول حاوی یون سیانید حل شود، واکنش رخ می دهد
FeCl 2cr + 6CN = 4 + 2Cl.
همین کمپلکس با افزودن محلول سیانید پتاسیم KCN به محلول FeCl 2 به دست می آید:
2 + 6CN = 4 + 6H 2 O.
این نشان می دهد که مجموعه سیانید قوی تر از مجموعه آبی است. علاوه بر این، خواص مغناطیسی کمپلکس سیانید نشان دهنده عدم وجود الکترون های جفت نشده در اتم آهن است. همه اینها به دلیل ساختار الکترونیکی کمی متفاوت این مجموعه است:

لیگاندهای "قوی تر" CN پیوندهای قوی تری با اتم آهن ایجاد می کنند، افزایش انرژی برای "شکستن" قانون هاند و آزاد کردن 3 کافی است. د-اوربیتال ها برای جفت های تنها لیگاند. ساختار فضایی مجموعه سیانید مانند مجموعه آبی است، اما نوع هیبریداسیون متفاوت است - د 2 sp 3 .
"قدرت" لیگاند در درجه اول به چگالی الکترونی ابری از جفت های تک الکترون بستگی دارد، یعنی با کاهش اندازه اتمی افزایش می یابد، با کاهش عدد کوانتومی اصلی، به نوع هیبریداسیون EO و برخی عوامل دیگر بستگی دارد. . مهمترین لیگاندها را می توان در یک سری "قدرت" فزاینده (نوعی "سری فعالیت" لیگاندها) مرتب کرد، این سری نامیده می شود. سری اسپکتروشیمیایی لیگاندها:
| من ؛ برادر : SCN، Cl، F، OH، H2O. : NCS، NH 3; SO 3 S : 2 ; : CN، CO |
برای مجتمع های 3 و 3، طرح های تشکیل به شرح زیر است:
|
|
برای مجتمع های با CN = 4، دو ساختار ممکن است: چهار وجهی (در مورد sp 3هیبریداسیون)، به عنوان مثال، 2، و یک مربع مسطح (در مورد dsp 2-هیبریداسیون)، به عنوان مثال، 2.
17.5. خواص شیمیایی ترکیبات پیچیده
ترکیبات پیچیده در درجه اول با همان خواص ترکیبات معمولی از همان کلاس ها (نمک ها، اسیدها، بازها) مشخص می شوند.
اگر ترکیب پیچیده اسید باشد، اسید قوی است و اگر باز باشد، باز قوی است. این خواص ترکیبات پیچیده تنها با حضور یون های H 3 O یا OH تعیین می شود. علاوه بر این، اسیدها، بازها و نمک های پیچیده وارد واکنش های تبادل معمولی می شوند، به عنوان مثال:
SO 4 + BaCl 2 = BaSO 4 + Cl 2
FeCl 3 + K 4 = Fe 4 3 + 3KCl
آخرین مورد از این واکنش ها به عنوان یک واکنش کیفی برای یون های Fe 3 استفاده می شود. ماده نامحلول به رنگ اولترامارین "آبی پروس" نامیده می شود [نام سیستماتیک: آهن (III) - هگزاسیانوفرات پتاسیم (II).
علاوه بر این، خود ذره پیچیده می تواند وارد واکنش شود و هر چه فعال تر باشد، پایداری آن کمتر است. معمولاً اینها واکنش های جایگزینی لیگاند هستند که در محلول رخ می دهند، به عنوان مثال:
2 + 4NH 3 = 2 + 4H 2 O،
و همچنین واکنش های اسید و باز مانند
2 + 2H 3 O = + 2H 2 O
2 + 2OH = + 2H 2 O
محصول تشکیل شده در این واکنش ها پس از جداسازی و خشک شدن به هیدروکسید روی تبدیل می شود:
Zn(OH) 2 + 2H 2 O
آخرین واکنش ساده ترین مثال از تجزیه یک ترکیب پیچیده است. در این مورد، در دمای اتاق رخ می دهد. سایر ترکیبات پیچیده هنگام گرم شدن تجزیه می شوند، به عنوان مثال:
SO4. H 2 O = CuSO 4 + 4NH 3 + H 2 O (بالای 300 o C)
4K 3 = 12KNO 2 + 4CoO + 4NO + 8NO 2 (بالای 200 درجه سانتیگراد)
K 2 = K 2 ZnO 2 + 2H 2 O (بالای 100 o C)
برای ارزیابی احتمال واکنش جایگزینی لیگاند، می توان از یک سری طیف شیمیایی استفاده کرد که با این واقعیت هدایت می شود که لیگاندهای قوی تر، لیگاندهای کمتر قوی را از کره داخلی جابجا می کنند.
17.6. ایزومری ترکیبات پیچیده
ایزومری ترکیبات پیچیده همراه است
1) با آرایش های مختلف ممکن لیگاندها و ذرات کره بیرونی،
2) با ساختار متفاوت خود ذره پیچیده.
گروه اول شامل هیدراته کردن(به طور کلی حل شدن) و یونیزاسیونایزومریسم، به دوم - فضاییو نوری.
ایزومری هیدرات با امکان توزیع متفاوت مولکول های آب در کره های بیرونی و درونی یک ترکیب پیچیده، به عنوان مثال: (رنگ قرمز قهوه ای) و Br 2 (رنگ آبی) همراه است.
ایزومر یونیزاسیون با امکان توزیع های مختلف یون ها در کره بیرونی و داخلی همراه است، به عنوان مثال: SO 4 (بنفش) و Br (قرمز). اولین مورد از این ترکیبات با واکنش با محلول باریم کلرید و دومی با محلول نیترات نقره رسوب تشکیل می دهند.
ایزومری فضایی (هندسی) که در غیر این صورت ایزومر سیس-ترانس نامیده می شود، مشخصه مجتمع های مربعی و هشت وجهی است (برای مجتمع های چهار وجهی غیرممکن است). مثال: ایزومر سیس-ترانس یک مجتمع مربعی

ایزومر نوری (آینه ای) اساساً هیچ تفاوتی با ایزومر نوری در شیمی آلی ندارد و مشخصه مجتمع های چهار وجهی و هشت وجهی است (برای مربع غیرممکن است).
- خرید مشترک اسباب بازی Polesie با قیمت خرید مشترک اسباب بازی برای کودکان
- خواهر میلیونر متوفی: "جیگوردا میلیون ها لیودمیلا را دریافت نخواهد کرد.
- تعیین اینکه اقامه دعوی در کدام دادگاه صحیح است
- کمک مالی برای یک دانشجو
- غرامت در ازای شیر: مبنای قانونی برای پرداخت و مالیات (لارینا ن
- حداکثر بهره وام در فدراسیون روسیه
- اسناد اولیه برای حسابداری دارایی های ثابت
- بدهی ها در فعالیت های یک شرکت: تعریف و تجزیه و تحلیل
- تعیین هزینه های لازم برای تامین نیروی کار سازمان
- ضریب دهک چقدر است؟
- روش های محاسبه کاهش هزینه محصول نحوه تعیین درصد کاهش هزینه
- ویژگی های دانشجویی که در حال گذراندن دوره کارآموزی در یک شرکت است: قوانین نوشتن مشخصات نمونه پس از اتمام دوره کارآموزی
- آب آمونیاکی: تهیه، فرمول، کاربرد محاسبه جرم مولی
- تهیه گزارش معاینه شیمیایی پزشکی قانونی اماکن و تجهیزات
- واکنش های جایگزینی لیگاند مکانیسم جایگزینی لیگاند
- جایگزینی الکتروفیل در سیستم های آروماتیک
- معادلات تعادل مواد و حرارت معادله تعادل مواد
- شناسایی داروها با استفاده از طیف سنجی مادون قرمز نزدیک
- کد کار پاره وقت
- تنها بازمانده سقوط هواپیما در نزدیکی یاروسلاول دادگاه را غافلگیر کرد